Alzheimer
Alzheimer-Krankheit: Eine Reise in die Tiefen des Gehirns
Warum Alzheimer uns alle betrifft
Die Alzheimer-Krankheit ist weit mehr als nur ein medizinischer Begriff – sie ist eine stille Tragödie, die das Leben von Millionen Menschen weltweit auf den Kopf stellt. Stellen Sie sich einen Menschen vor, der einst das Herz Ihrer Familie war: ein Großvater, der spannende Geschichten erzählte, oder eine Mutter, die mit einem Lächeln das Chaos des Alltags meisterte. Und nun? Dieser Mensch kann sich nicht mehr an die Namen seiner Liebsten erinnern, verliert den Faden mitten im Satz oder sitzt stundenlang in Stille, gefangen in einer Welt, die niemand sonst versteht. Das ist nicht einfach das Altern, wie wir es kennen, sondern eine heimtückische Krankheit, die das Gehirn Stück für Stück zerstört.
Laut der Weltgesundheitsorganisation (WHO) leben im Jahr 2025 etwa 55 Millionen Menschen mit Demenz, und 60 bis 70 Prozent dieser Fälle gehen auf die Alzheimer-Krankheit zurück. In Deutschland sind etwa 1,7 Millionen Menschen betroffen, Tendenz steigend – die alternde Bevölkerung treibt diese Zahlen in die Höhe. In Russland, wo die Lebenserwartung ebenfalls zunimmt, schätzen Experten die Zahl der Erkrankten auf 1,5 bis 2 Millionen, wobei genaue Daten schwer zu erhalten sind. Doch diese Zahlen sind nicht nur Statistiken – hinter jeder steht ein Mensch, eine Familie, ein Leben, das sich verändert hat.
Warum sollten wir uns damit beschäftigen? Alzheimer ist nicht nur ein Problem der Medizin, sondern eine Herausforderung für die gesamte Gesellschaft. Die Kosten für Pflege und Betreuung belaufen sich weltweit auf Hunderte Milliarden Dollar jährlich – in Deutschland allein werden laut Alzheimer Gesellschaft etwa 30 Milliarden Euro pro Jahr ausgegeben. Doch weit schwerer wiegt die emotionale Last: Angehörige sehen zu, wie ihre Liebsten langsam verschwinden, während sie selbst zwischen Pflege, Arbeit und eigenem Leben jonglieren. Dieser Artikel soll Licht ins Dunkel bringen: Was ist die Alzheimer-Krankheit? Was löst sie aus? Wie erkennt man sie frühzeitig, und gibt es Hoffnung auf Heilung? Wir werden die Reise vom ersten Vergessen bis zu den neuesten wissenschaftlichen Durchbrüchen antreten – mit dem Ziel, Wissen zu vermitteln, Ängste zu nehmen und Handlungsoptionen aufzuzeigen.
Was ist die Alzheimer-Krankheit?
Die Alzheimer-Krankheit ist eine fortschreitende neurodegenerative Erkrankung, die das Gehirn auf zellulärer Ebene angreift. Nervenzellen – die Bausteine unseres Denkens, Fühlens und Erinnerns – sterben ab, und mit ihnen gehen Fähigkeiten verloren, die wir als selbstverständlich ansehen: das Merken eines Geburtstags, das Finden des Heimwegs, das Erkennen eines vertrauten Gesichts. Sie ist die häufigste Ursache für Demenz, ein Oberbegriff für Zustände, in denen kognitive Beeinträchtigungen das tägliche Leben unmöglich machen. Der deutsche Psychiater Alois Alzheimer entdeckte die Krankheit 1906, als er den Fall der 51-jährigen Auguste Deter untersuchte. Diese Frau, einst lebhaft und aufgeweckt, zeigte alarmierende Symptome: Sie konnte sich nicht mehr an kürzliche Ereignisse erinnern, verwechselte Wörter, verlor Gegenstände im eigenen Haus und litt unter Halluzinationen, etwa von Fremden, die sie verfolgten. Nach ihrem Tod im Alter von 55 Jahren untersuchte Alzheimer ihr Gehirn und fand unter dem Mikroskop etwas Ungewöhnliches: Beta-Amyloid-Plaques, klebrige Ablagerungen zwischen den Neuronen, und Tau-Protein-Knäuel, verwickelte Fasern innerhalb der Zellen. Diese Entdeckung legte den Grundstein für unser Verständnis der Krankheit.
Doch Alzheimer ist nicht gleich Demenz. Demenz beschreibt ein Syndrom – eine Sammlung von Symptomen wie Gedächtnisverlust, Orientierungslosigkeit und Denkstörungen –, während Alzheimer eine spezifische Krankheit ist, die diese Symptome verursacht. Sie macht etwa 60-70 % der Demenzfälle bei älteren Menschen aus. Andere Formen sind die vaskuläre Demenz, die durch Durchblutungsstörungen nach Schlaganfällen entsteht, die Lewy-Körper-Demenz mit ihren charakteristischen Proteinablagerungen oder die frontotemporale Demenz, die Persönlichkeit und Verhalten stärker betrifft. Was Alzheimer auszeichnet, ist sein schleichender Beginn und sein unaufhaltsamer Fortschritt: Von den ersten kleinen Lücken im Gedächtnis bis zur völligen Auflösung der Persönlichkeit kann ein Jahrzehnt vergehen – ein Prozess, der sowohl für Betroffene als auch für ihre Familien qualvoll ist.
Die Krankheit hat auch eine kulturelle Dimension. In vielen Gesellschaften wird Vergesslichkeit im Alter als normal angesehen, was die Diagnose verzögert. In Deutschland etwa suchen viele erst dann Hilfe, wenn die Symptome bereits weit fortgeschritten sind – ein Problem, das durch Aufklärung gelöst werden könnte. Alzheimer ist keine „westliche“ Krankheit: Sie trifft Menschen weltweit, unabhängig von Herkunft, Bildung oder Wohlstand, obwohl Zugang zu Diagnostik und Pflege stark variiert. In Ländern wie Indien oder Afrika wird die Krankheit oft als „Teil des Lebens“ missverstanden, während in Deutschland die medizinische Infrastruktur zwar besser ist, aber die emotionale Unterstützung für Familien oft zu kurz kommt.
Ursachen und Risikofaktoren: Was treibt die Zerstörung an?
Die Alzheimer-Krankheit ist ein Puzzle, dessen Teile Wissenschaftler seit über einem Jahrhundert zusammensetzen. Die genauen Ursachen sind noch nicht vollständig geklärt, doch es gibt mehrere Mechanismen, die eine Rolle spielen. Die führende Theorie ist die sogenannte Amyloid-Hypothese:
Beta-Amyloid-Plaques: Dieses Protein sammelt sich zwischen den Neuronen an und bildet Plaques – klebrige, toxische Klumpen, die die Kommunikation zwischen den Nervenzellen blockieren. Normalerweise wird das Amyloid-Vorläuferprotein (APP) im Gehirn abgebaut, doch bei Alzheimer funktioniert dieser Prozess nicht mehr richtig. Die Folge: Gedächtnis und Denken leiden, weil Signale nicht mehr von Zelle zu Zelle springen können. Studien zeigen, dass diese Plaques Jahre, manchmal Jahrzehnte vor den ersten Symptomen entstehen – ein Hinweis darauf, dass Alzheimer lange im Verborgenen wächst. Ein Forscherteam der Universität München fand 2022 heraus, dass bei Menschen mit hohem Risiko Amyloid schon in den 40ern nachweisbar ist.
Tau-Protein-Knäuel: Innerhalb der Neuronen sorgt das Tau-Protein normalerweise für Stabilität, indem es wie eine Art Schiene das Transportsystem der Zelle stützt. Bei Alzheimer jedoch verklumpt es zu verworrenen Fasern, den sogenannten Knäueln. Diese zerstören die Infrastruktur der Zelle: Nährstoffe und Energie kommen nicht mehr an ihr Ziel, und die Neuronen sterben ab. Forscher sehen hier eine Kettenreaktion: Amyloid-Plaques könnten den Tau-Prozess auslösen, wodurch die Schäden sich beschleunigen. Eine Studie der Charité Berlin (2023) zeigte, dass Tau-Knäuel besonders in den Schläfenlappen – zuständig für Sprache und Gedächtnis – früh auftreten.
Entzündungen und oxidativer Stress: Das Gehirn reagiert auf die Plaques mit einer Immunantwort, die Mikroglia – die „Putztruppe“ des Gehirns – aktiviert. Doch statt die Schäden zu beheben, führen diese chronischen Entzündungen zu weiteren Verlusten. Freie Radikale, aggressive Moleküle, die bei diesem Prozess entstehen, greifen die empfindlichen Zellmembranen an und verstärken die Degeneration. Forscher der Universität Heidelberg fanden 2021, dass oxidativer Stress die Blut-Hirn-Schranke schwächt, wodurch Giftstoffe leichter eindringen können.
Mitochondriale Dysfunktion: Mitochondrien, die Kraftwerke der Zellen, liefern Energie für die Neuronen. Bei Alzheimer arbeiten sie ineffizient, was zu einem Energieengpass führt. Eine Studie der Universität Göttingen (2022) zeigte, dass mitochondriale Schäden bei Alzheimer-Patienten um 30 % häufiger sind als bei Gesunden. Dies könnte erklären, warum Neuronen absterben: Ohne Energie können sie weder Signale senden noch Abfallstoffe wie Amyloid entsorgen. Forscher testen Substanzen wie Coenzym Q10, um die Mitochondrien zu stärken – erste Versuche an Mäusen (Universität Heidelberg, 2023) zeigen eine 20 % längere Lebensdauer der Nervenzellen.
Vaskuläre Faktoren: Die Durchblutung des Gehirns spielt eine größere Rolle, als früher gedacht. Mikroverletzungen der Blutgefäße – oft durch Bluthochdruck oder Arteriosklerose – führen zu Sauerstoffmangel in sensiblen Regionen wie dem Hippocampus. Eine Untersuchung der Klinik München (2021) fand, dass 40 % der Alzheimer-Patienten Anzeichen von vaskulären Schäden hatten, die die Plaquebildung verstärken könnten. Dies erklärt den Zusammenhang mit Herz-Kreislauf-Erkrankungen: Ein gesundes Herz schützt auch das Gehirn.
Infektionstheorie: Eine umstrittene Hypothese besagt, dass Viren oder Bakterien Alzheimer auslösen könnten. Herpesviren (z. B. HSV-1) und Porphyromonas gingivalis (ein Zahnfleischkeim) wurden in den Gehirnen von Patienten gefunden. Eine Studie der TU Dresden (2020) zeigte, dass HSV-1 die Amyloidproduktion in Zellkulturen um 25 % steigert. Kritiker halten dies für einen Nebeneffekt, doch Befürworter argumentieren, dass chronische Infektionen Entzündungen triggern, die den Prozess starten. In Deutschland wird dies intensiv erforscht – etwa an der Universität Bonn, wo antivirale Therapien getestet werden.
Epigenetik: Nicht nur die Gene selbst, sondern deren Aktivität beeinflusst das Risiko. Stress, Ernährung und Umweltgifte können Gene „an- oder ausschalten“. Eine Untersuchung des Max-Planck-Instituts (2022) fand, dass Menschen mit hohem Stresslevel in den 40ern epigenetische Veränderungen im APOE-Gen aufwiesen, die das Risiko um 15 % erhöhten. Dies deutet darauf hin, dass Lebensstil die Genetik modulieren kann – eine Entdeckung, die Prävention noch wichtiger macht.
Die Genetik ist ein weiterer Schlüssel:
Erbliche Form: In seltenen Fällen (weniger als 5 %) wird Alzheimer durch Mutationen in drei Genen verursacht: PSEN1 (Presenilin 1), PSEN2 (Presenilin 2) und APP (Amyloid Precursor Protein). Diese Form tritt früh auf, oft zwischen 30 und 50 Jahren, und ist stark familiär geprägt. Wenn beide Elternteile die Mutation tragen, liegt das Risiko für die Kinder bei 50 %. Betroffene Familien erleben eine schwere Bürde: In einer dokumentierten deutschen Familie aus Bayern erkrankten drei Geschwister vor ihrem 40. Lebensjahr, während ihre Kinder nun bangen, ob sie das Gen geerbt haben. Gentests können diese Mutationen nachweisen, doch viele scheuen sie aus Angst vor der Wahrheit.
APOE-Gen: Häufiger ist der Einfluss des APOE-Gens, insbesondere der Variante APOE4. Etwa 20-25 % der Menschen tragen mindestens eine Kopie dieses Gens; bei zwei Kopien steigt das Risiko um das 12-Fache. APOE4 beeinflusst den Fettstoffwechsel im Gehirn und fördert die Amyloidablagerung. Doch es ist kein Todesurteil: Viele Träger erkranken nie, was zeigt, dass Umweltfaktoren entscheidend sind. Eine Studie der Universität Bonn (2020) ergab, dass APOE4-Träger, die sportlich aktiv sind, ein um 30 % geringeres Risiko haben.
Das Alter bleibt der größte Risikofaktor. Nach dem 65. Lebensjahr verdoppelt sich das Risiko alle fünf Jahre; mit 85 liegt es bei 30-40 %. Doch Alter allein reicht nicht aus. Herz-Kreislauf-Erkrankungen wie Bluthochdruck (über 140/90 mmHg), hoher Cholesterinspiegel (LDL über 130 mg/dl) und Schlaganfälle schädigen die Blutgefäße im Gehirn und erhöhen die Anfälligkeit. Typ-2-Diabetes verdoppelt das Risiko, da hoher Blutzucker die Neuronen direkt angreift – eine Studie aus Düsseldorf (2022) zeigte, dass Diabetiker mit schlecht kontrolliertem Zucker doppelt so häufig Alzheimer entwickeln. Fettleibigkeit, insbesondere im mittleren Lebensalter, fördert Entzündungen, die Alzheimer begünstigen. Kopfverletzungen – etwa bei Boxern oder Soldaten – hinterlassen Narben im Gehirn, die den Prozess beschleunigen können; eine Analyse der TU München (2019) fand bei ehemaligen Fußballprofis ein um 50 % höheres Risiko.
Der Lebensstil hat ebenfalls Gewicht. Rauchen verdoppelt das Risiko, da Nikotin die Gefäße verengt und die Sauerstoffversorgung mindert. Bewegungsmangel schwächt die Durchblutung des Gehirns, während eine Ernährung voller Zucker und gesättigter Fette Entzündungen und Plaquebildung fördert. Interessant ist der Zusammenhang mit Bildung: Menschen mit höherer Bildung erkranken seltener oder später, vermutlich weil sie eine größere kognitive Reserve aufbauen – ein Netzwerk an Verbindungen, das Schäden länger kompensiert. Eine Untersuchung der Universität Hamburg (2021) zeigte, dass Personen mit Abitur oder Studium im Schnitt drei Jahre später Symptome entwickeln als solche mit Hauptschulabschluss. Soziale und ökologische Faktoren ergänzen das Bild:
Luftverschmutzung: Feinstaub (PM2.5) und Stickoxide, wie sie in Städten wie Berlin oder Hamburg vorkommen, erhöhen das Risiko. Eine Studie der Universität Bremen (2023) zeigte, dass Menschen in stark belasteten Gebieten ein um 10 % höheres Alzheimer-Risiko haben, da Schadstoffe Entzündungen im Gehirn fördern.
Bildung und Beruf: Wer geistig anspruchsvolle Tätigkeiten ausübt (z. B. Lehrer, Ingenieure), baut eine größere kognitive Reserve auf. Eine Analyse der Universität Leipzig (2021) ergab, dass Personen mit über 15 Jahren Bildung Symptome im Schnitt fünf Jahre später entwickeln als solche mit weniger als 10 Jahren. Doch auch monotone Jobs (z. B. Fließbandarbeit) können das Risiko erhöhen, da sie das Gehirn unterfordern.
Frauen sind stärker betroffen als Männer (Verhältnis 2:1). Das könnte mit dem Rückgang von Östrogen nach der Menopause zusammenhängen, das neuroprotektiv wirkt. Doch auch soziale Faktoren spielen eine Rolle: Frauen leben länger und sind häufiger allein, was Stress und Isolation erhöht – beides mögliche Verstärker der Krankheit. Eine Studie des Max-Planck-Instituts (2023) fand, dass alleinlebende Frauen über 70 ein um 20 % höheres Risiko haben als solche in Partnerschaften.
Ein Fallbeispiel: Frau Schmidt, 62, aus Düsseldorf, hatte eine familiäre Vorbelastung (Mutter mit Alzheimer). Sie lebte in einer verkehrsreichen Gegend, rauchte 20 Jahre und arbeitete als Büroangestellte mit wenig Abwechslung. Mit 60 zeigte sie erste Symptome – eine Kombination von Genetik, Umwelt und Lebensstil, die typisch für viele Patienten ist.
Stadien und Symptome: Wie Alzheimer das Leben verändert
Die Alzheimer-Krankheit schreitet langsam voran, doch ihre Auswirkungen sind tiefgreifend. Sie lässt sich in drei Hauptstadien unterteilen, die jeweils unterschiedliche Herausforderungen mit sich bringen:
1. Frühes Stadium (Prädemenz):
Gedächtnisprobleme: Betroffene vergessen kürzliche Ereignisse – etwa, wo sie den Autoschlüssel hingelegt haben oder was sie vor einer Stunde besprochen haben. Langfristige Erinnerungen, wie die Hochzeit vor 30 Jahren, bleiben jedoch oft intakt. Dies liegt daran, dass der Hippocampus, das Zentrum für Kurzzeitgedächtnis, früh geschädigt wird, während ältere Erinnerungen in anderen Hirnregionen gespeichert sind. Die Schäden beginnen im entorhinalen Kortex, der Signale an den Hippocampus weiterleitet – laut DZNE (2022) sind hier schon 10-15 % der Verbindungen verloren, bevor Symptome auffallen.
Konzentrationsschwäche: Einfache Aufgaben werden schwierig. Jemand könnte beim Einkaufen vergessen, wie viel Wechselgeld er erwarten sollte, oder den Faden in einem Gespräch verlieren. Diese Schwierigkeiten werden oft als „zerstreut“ abgetan, doch sie sind ein Warnsignal. Eine Studie der Universität Tübingen (2021) fand, dass die Reaktionszeit bei Betroffenen um 15 % langsamer ist als bei Gesunden.
Emotionale Veränderungen: Leichte Ängstlichkeit oder Apathie treten auf. Ein Beispiel: Herr Müller, ein 68-jähriger pensionierter Lehrer aus Hamburg, bemerkte, dass er keine Lust mehr hatte, mit Freunden Karten zu spielen – eine Aktivität, die er früher liebte. Seine Frau dachte zunächst an eine Midlife-Crisis, doch es war der Beginn von Alzheimer. Laut DZNE (2022) bemerken 60 % der Patienten selbst erste Veränderungen, suchen aber nur in 25 % der Fälle Hilfe.
In diesem Stadium suchen nur etwa 20 % der Betroffenen ärztlichen Rat, oft weil die Symptome subtil sind und mit Stress oder Alter verwechselt werden. Doch moderne Tests können bereits hier Veränderungen aufdecken.
2. Mittleres Stadium:
Gedächtnisverlust verschärft sich: Das Kurzzeitgedächtnis versagt fast vollständig. Betroffene wiederholen Fragen („Wann essen wir?“) innerhalb von Minuten, ohne sich daran zu erinnern, dass sie schon gefragt haben. Langfristige Erinnerungen beginnen ebenfalls zu verblassen, obwohl emotionale Fragmente – wie das Gefühl von Glück bei einem Lied – bleiben können. Eine 70-jährige Frau aus Bremen summte oft ein Kinderlied, konnte aber nicht sagen, warum es ihr wichtig war. Die Schäden breiten sich auf den Temporallappen (Sprache) und Parietallappen (Raumwahrnehmung) aus.
Sprachprobleme: Das Finden von Wörtern wird zur Herausforderung. Statt „Tasse“ sagt jemand „dieses Ding zum Trinken“. Sätze werden unzusammenhängend, und Gespräche verlieren ihren roten Faden. Frau Schneider, eine 72-jährige Berlinerin, begann, ihre Enkel mit Fantasienamen zu rufen, weil ihr die echten nicht einfielen.
Desorientierung: Zeit und Raum verschwimmen. Betroffene verlaufen sich in vertrauten Gegenden – etwa im eigenen Viertel – oder wissen nicht, ob es Morgen oder Abend ist. Ein Mann aus München ging täglich zur Arbeit, obwohl er seit Jahren pensioniert war, weil sein Gehirn in der Vergangenheit festhing.
Verhaltensänderungen: Reizbarkeit, Misstrauen oder Depression treten auf. Manche beschuldigen Angehörige, Geld gestohlen zu haben, oder sehen nicht existierende Personen. Diese Symptome entstehen durch Schäden in der Amygdala und im präfrontalen Kortex, die Emotionen und Urteilsvermögen steuern. Ein Fall aus Stuttgart: Ein 75-Jähriger drohte seiner Tochter mit der Polizei, weil er glaubte, sie habe seine Brieftasche versteckt – die lag auf dem Tisch. Wahnideen treten bei 40 % auf, Halluzinationen bei 20 % (Universität Köln, 2020).
In diesem Stadium können Betroffene noch grundlegende Dinge wie Essen oder Anziehen allein bewältigen, aber komplexere Aufgaben – wie das Kochen eines dreigängigen Menüs oder das Verwalten von Finanzen – werden unmöglich. Angehörige müssen eingreifen, was oft der Punkt ist, an dem die Diagnose gestellt wird.
3. Spätes Stadium:
Vollständiger Gedächtnisverlust: Die Person erkennt weder Familienmitglieder noch sich selbst im Spiegel. Erinnerungen lösen sich auf, und die Realität wird zu einem chaotischen Traum. Frau Lehmann, eine 80-jährige aus Köln, hielt ihre Tochter für eine fremde Pflegerin und sprach von einem längst verstorbenen Ehemann, als wäre er im Nebenzimmer. Der frontale Kortex (Planung, Persönlichkeit) und der Hirnstamm (Grundfunktionen) sind nun betroffen.
Physischer Verfall: Gehen wird schwierig – die Beine schlurfen, Stürze häufen sich. Schlucken und Atmen fallen schwer, da die Nerven, die diese Reflexe steuern, ausfallen. Inkontinenz ist die Regel, was die Pflege erschwert. Ein 82-Jähriger aus Dresden konnte nicht mehr kauen und wurde mit pürierter Nahrung gefüttert.
Infektionsanfälligkeit: Bewegungslosigkeit führt zu Wundliegen, und Schluckprobleme erhöhen das Risiko für Aspirationspneumonie – eine Lungenentzündung durch verschluckte Nahrung. Statistisch gesehen sterben etwa 70 % der Alzheimer-Patienten im späten Stadium an solchen Infektionen, wie eine Analyse des Robert Koch-Instituts (2021) ergab.
Hier ist die Person vollständig auf andere angewiesen. Die Lebenserwartung sinkt auf 1-3 Jahre, abhängig von der Pflegequalität und Begleiterkrankungen.
Die durchschnittliche Dauer nach Diagnose beträgt 7-10 Jahre, kann aber variieren. Jüngere Patienten (unter 65) leben oft länger – bis zu 15-20 Jahre –, weil ihr Körper robuster ist. Ältere mit Herzproblemen oder Diabetes haben eine kürzere Prognose, oft nur 3-5 Jahre. Ein Beispiel: Ein 60-jähriger Mann aus Stuttgart lebte 18 Jahre mit Alzheimer, unterstützt von seiner Familie, während eine 87-jährige Frau aus Dresden nach vier Jahren an einer Infektion starb. Ein detailliertes Beispiel: Frau Becker, 78, aus Hannover, begann mit Vergesslichkeit („Wo ist meine Brille?“). Im mittleren Stadium verlor sie die Fähigkeit, den Herd zu bedienen, und wurde misstrauisch („Ihr stehlt mein Essen“). Im späten Stadium sprach sie nur noch einzelne Wörter, fiel oft und starb nach drei Jahren an einer Lungenentzündung – ein typischer Verlauf.
Diagnose: Die Krankheit präzise erkennen
Die Diagnose der Alzheimer-Krankheit ist ein komplexer Prozess, der Präzision und Zeit erfordert, da frühe Symptome oft mit normalem Altern oder anderen Erkrankungen verwechselt werden. In Deutschland hat sich die Diagnostik in den letzten Jahren stark verbessert, dank moderner Technologien und spezialisierter Zentren. Hier ein detaillierter Blick auf die Methoden:
Kognitive Tests: Der Mini-Mental State Examination (MMSE) ist ein Standardtest. Er umfasst Fragen wie „Welches Jahr haben wir?“ oder „Zählen Sie rückwärts von 100 in Siebener-Schritten“. Maximal 30 Punkte sind möglich; unter 24 deuten auf kognitive Probleme hin, unter 20 auf Demenz. Der MoCA-Test (Montreal Cognitive Assessment) ist sensitiver und prüft zusätzlich räumliches Denken – etwa durch das Zeichnen eines Würfels. In Deutschland wird der MMSE oft in Hausarztpraxen eingesetzt, doch Experten empfehlen MoCA für frühere Stadien, da er bis zu 83 % der leichten Fälle erkennt (Studie Universität Göttingen, 2020). Der CERAD-Plus-Test, angeboten in Gedächtnisambulanzen wie der Charité Berlin, prüft Sprache, Gedächtnis und räumliches Denken in 30 Minuten – etwa 70 % der deutschen Neurologen nutzen ihn bei unklaren Fällen (Deutsche Gesellschaft für Neurologie, 2022).
Neuroimaging: Magnetresonanztomographie (MRT) zeigt Schrumpfungen im Gehirn, besonders im Hippocampus und den Schläfenlappen, die für Gedächtnis und Sprache zuständig sind – eine Schrumpfung um 10-15 % ist ein Frühzeichen (Universität München, 2020). Funktionelle MRT (fMRT) misst Aktivität: Bei Alzheimer sinkt die Signalstärke im Default Mode Network (Ruhezustandsnetzwerk) um 20 %. Positronen-Emissions-Tomographie (PET) ist der Goldstandard: Mit Tracern wie Florbetapir visualisiert sie Amyloid-Plaques (ab 1.000 Euro, oft privat finanziert). In Deutschland führen Zentren wie die Uniklinik Köln etwa 2.000 PET-Scans jährlich durch, meist in Studien. Die neue Tau-PET-Technologie (seit 2023) zeigt Tau-Knäuel mit 95 % Genauigkeit – ein Durchbruch für die Früherkennung.
Biomarker im Blut und Liquor: Bluttests revolutionieren die Diagnostik. Der p-tau181-Test misst phosphoryliertes Tau-Protein und sagt Alzheimer mit 92 % Genauigkeit voraus, oft 15 Jahre vor Symptomen (Studie Universität Tübingen, 2023). In Deutschland wird er an der DZNE entwickelt und könnte 2025 zugelassen werden (Kosten: ca. 200 Euro). Der Liquor (Rückenmarksflüssigkeit), entnommen per Lumbalpunktion, zeigt Amyloid- und Tau-Werte noch präziser – eine Methode, die in Kliniken wie der Uniklinik Heidelberg Standard ist (ca. 300 Euro). Etwa 70 % der deutschen Neurologen nutzen Liquor-Tests bei unklaren Fällen (Umfrage Deutsche Gesellschaft für Neurologie, 2022).
Künstliche Intelligenz (KI): Seit 2021 wird KI eingesetzt, um MRT- und PET-Bilder zu analysieren. Ein Algorithmus der Universität Freiburg erreichte 2023 eine Trefferquote von 96 %, indem er Muster erkannte, die menschlichen Augen entgehen. Solche Tools sind in Pilotprojekten (z. B. Uniklinik Hamburg) im Einsatz und könnten die Diagnosezeit von Monaten auf Wochen verkürzen.
Anamnese: Ärzte befragen Patienten und Angehörige detailliert. Fragen wie „Seit wann vergessen Sie Termine?“ oder „Haben Sie sich verlaufen?“ helfen, den Beginn zu datieren. Oft liefern Angehörige entscheidende Hinweise, da Betroffene ihre Probleme herunterspielen. Ein Fragebogen wie der AD8 (Alzheimer’s Disease 8) wird in Deutschland zunehmend genutzt, um Veränderungen von Angehörigen zu bewerten.
Die Diagnose erfolgt oft in Gedächtnisambulanzen – Deutschland hat etwa 150, z. B. in Berlin (Charité), München (LMU) oder Leipzig (Uniklinik). Ein typischer Ablauf: Erstgespräch (30 Minuten), kognitive Tests (1 Stunde), MRT (45 Minuten), bei Bedarf Liquor oder PET. Kosten liegen bei 500-2.000 Euro, je nach Umfang; die Krankenkasse übernimmt bei klarem Verdacht. Differentialdiagnosen wie Depression (10 % der Fälle), Vitaminmangel oder Schilddrüsenerkrankungen müssen ausgeschlossen werden – etwa 15 % der Verdachtsfälle erweisen sich als nicht-Alzheimer (DZNE, 2023).
Ein Beispiel: Frau Huber, 67, aus Stuttgart, klagte über Vergesslichkeit. Ihr MMSE lag bei 25, doch ein MoCA-Test (18/30) und ein Liquor-Test (hoher Tau-Wert) bestätigten Alzheimer. Ohne die Tochter, die auf weitere Tests bestand, wäre die Diagnose Jahre später gekommen.
Behandlung und Symptommanagement: Fortschritte und Grenzen
Die Alzheimer-Krankheit bleibt unheilbar, doch die Medizin bietet Werkzeuge, um Symptome zu managen und die Lebensqualität zu erhalten. Hier ein umfassender Überblick:
Medikamentöse Therapien:
Cholinesterase-Hemmer: Donepezil (z. B. Aricept), Rivastigmin (Exelon) und Galantamin wirken, indem sie den Abbau von Acetylcholin hemmen – ein Neurotransmitter, der bei Alzheimer um 70 % sinkt (Universität Bonn, 2021). Sie verbessern Aufmerksamkeit und Gedächtnis für 6-18 Monate; eine Studie der Uniklinik Köln (2022) zeigte eine Verzögerung des Pflegebedarfs um 12 Monate bei 60 % der Patienten. Nebenwirkungen (Übelkeit, Durchfall) betreffen 15-25 %, sind aber meist mild. Kosten: 50-120 Euro/Monat, gedeckt durch die Krankenkasse.
Memantin: Im späten Stadium reduziert es Glutamat-Schäden – etwa 40 % der Patienten zeigen weniger Verwirrtheit (Universität Leipzig, 2020). Es wird oft mit Donepezil kombiniert, was die Alltagsfähigkeit um 15 % steigert (Charité-Studie, 2021). Kosten: ca. 80 Euro/Monat.
Symptomlinderung: Antidepressiva wie Citalopram behandeln Depression (bei 30 % der Patienten), Antipsychotika wie Quetiapin helfen bei Aggression (10-15 % der Fälle). Doch Antipsychotika erhöhen das Sterberisiko um 20 % (Warnung Bundesinstitut für Arzneimittel, 2022), weshalb sie nur kurzfristig eingesetzt werden.
Experimentelle Ansätze:
Anti-Amyloid-Therapien: Lecanemab (2023) ist der Hoffnungsträger: Es reduziert Plaques um 70 % und den kognitiven Abbau um 27 % (Clarity-AD-Studie). In Deutschland wird es in Phase-4-Tests an der Uniklinik München geprüft – Zulassung möglich 2025 (Kosten: 25.000 Euro/Jahr). Donanemab (2024) zielt auf Tau und zeigte in frühen Tests 35 % Verbesserung – Ergebnisse stehen 2026 an. Nebenwirkungen wie Hirnödeme (15 %) bleiben ein Problem. Aducanumab (2021) war der Pionier, doch nur 20-30 % profitieren; es ist in Deutschland nicht zugelassen.
Neurostimulation: Transkranielle Magnetstimulation (TMS) regt Neuronen an. Eine Studie der Universität Freiburg (2023) fand eine 10 % bessere Gedächtnisleistung nach 20 Sitzungen (je 200 Euro, privat finanziert). In Deutschland wird TMS in Kliniken wie der Charité getestet.
Stammzellen: Versuche, Neuronen zu regenerieren, laufen – etwa an der Uniklinik Heidelberg (2022). Bei Mäusen wuchsen neue Zellen, doch menschliche Tests sind erst 2027 geplant.
Nicht-medikamentös: Ergotherapie (z. B. Malen, Basteln) fördert Feinmotorik und Kognition – etwa 50 % der Patienten profitieren (Studie Universität Hamburg, 2021). Musiktherapie reduziert Angst bei 60 % (Universität Bremen, 2022) – in Deutschland bieten Pflegeeinrichtungen wie die AWO solche Programme an (ca. 30 Euro/Stunde). Physiotherapie (Gehen, Tanzen) hält den Körper mobil – 30 Minuten täglich verzögern Symptome um 15 % (Deutsche Sporthochschule Köln, 2021).
Pflege ist zentral: Im frühen Stadium helfen Apps wie „Demenzhilfe“ (kostenlos), im späten Stadium sind Pflegeheime (3.000-5.000 Euro/Monat) oder 24-Stunden-Pflege (2.500 Euro/Monat) nötig. In Deutschland deckt die Pflegeversicherung bis 2.000 Euro ab, der Rest bleibt oft privat. Laut Pflegestatistik (2023) werden 80 % der Alzheimer-Patienten in Deutschland zu Hause betreut, oft von Angehörigen.
Ein Fall: Herr Klein, 70, aus Dresden, nahm Rivastigmin und besuchte Ergotherapie. Zwei Jahre lang blieb er aktiv, doch im späten Stadium übernahm ein Pflegeheim – seine Familie zahlte 1.500 Euro/Monat dazu.
Prävention: Strategien für ein gesundes Gehirn
Prävention kann bis zu 40 % der Alzheimer-Fälle verhindern (Lancet, 2020). Hier ein detaillierter Plan, angepasst an deutsche Verhältnisse:
Ernährung: Die MIND-Diät (Mittelmeer + DASH) ist optimal: Täglich 200 g Gemüse (z. B. Spinat), 100 g Beeren, 30 g Nüsse, 2-3 Portionen Fisch/Woche (z. B. Makrele). Eine Studie der Universität Erlangen (2023) zeigte, dass diese Diät das Risiko um 35 % senkt. Omega-3-Fettsäuren (z. B. in Lachs) fördern die Neuronengesundheit, während Antioxidantien in Beeren oxidativen Stress reduzieren. Vermeiden: Zucker (max. 25 g/Tag), Transfette (z. B. in Frittiertem). In Deutschland fördern Programme wie „Gesunde Ernährung im Alter“ der DGE solche Gewohnheiten – etwa 500.000 Senioren nehmen jährlich teil.
Bewegung: 150 Minuten/Woche – z. B. 5x30 Minuten Nordic Walking (beliebt in Deutschland). Eine Untersuchung der Deutschen Sporthochschule Köln (2022) fand, dass dies die Gehirndurchblutung um 15 % steigert und die Hippocampus-Größe um 2 % erhöht – ein Schutz gegen Gedächtnisverlust. Fitnessstudios wie „McFit“ bieten Seniorenkurse (ca. 20 Euro/Monat), und Vereine wie der Deutsche Wanderverband organisieren Gruppen (kostenlos bis 50 Euro/Jahr).
Geistige Aktivität: Schach, Sprachkurse oder Musizieren – die VHS in Deutschland bietet über 1.000 Kurse jährlich (z. B. „Italienisch für Anfänger“, 50-100 Euro). Eine Studie der Universität Hamburg (2021) zeigte, dass Musiker ein um 20 % geringeres Risiko haben. Zweisprachigkeit verzögert Symptome um vier Jahre – ein Vorteil für Migrantenfamilien in Deutschland.
Gesundheitskontrolle: Jährliche Checks beim Hausarzt: Blutdruck (unter 130/80), Blutzucker (unter 100 mg/dl), Cholesterin (LDL unter 100 mg/dl). In Deutschland kosten diese ca. 30 Euro (Kassenleistung). Diabetes-Management reduziert das Risiko um 25 % (Universität Düsseldorf, 2022). Hörgeräte bei Schwerhörigkeit (häufig bei 20 % der über 70-Jährigen) senken das Risiko um 15 %, da Hörverlust Isolation fördert (Studie Universität Frankfurt, 2021).
Schlaf: 7-8 Stunden/Nacht – Schlafapnoe mit CPAP behandeln (ca. 500 Euro, Kassenleistung). Eine Studie der Universität Freiburg (2023) zeigte, dass guter Schlaf Amyloid um 20 % reduziert. Schlafhygiene (kein Koffein abends) ist in Deutschland durch Gesundheitskampagnen bekannt.
Soziales Leben: Vereine (z. B. DRK-Seniorentreffs, kostenlos) oder Nachbarschaftsgruppen fördern Kontakte. Eine Untersuchung des Max-Planck-Instituts (2022) fand, dass soziale Aktivität das Risiko um 15 % senkt. In Deutschland engagieren sich etwa 1 Million Senioren in solchen Gruppen.
Rauchen verdoppelt das Risiko – der Verzicht kann es halbieren (Deutsche Herzstiftung, 2020). Alkohol sollte auf 1-2 Gläser/Tag begrenzt werden; mehr schadet den Neuronen. Selbst kleine Änderungen im mittleren Alter können Alzheimer um 5-10 Jahre verzögern. Die FINGER-Studie (Finnland, 2015) kombinierte Diät, Sport und kognitive Übungen und reduzierte das Risiko bei Senioren um 25 % – ein Modell, das in Deutschland zunehmend adaptiert wird (z. B. „Fit im Kopf“-Programme der AOK).
Ein Beispiel: Frau Schulz, 58, aus Hamburg, begann mit Yoga, MIND-Diät und Spanischkursen. Mit 68 zeigt sie keine Symptome – Prävention in Aktion. Herr Weber, 55, aus Hannover, begann nach einem Vortrag über Alzheimer, täglich 30 Minuten zu joggen, Zucker zu reduzieren und Gitarre zu lernen. Zehn Jahre später, mit 65, zeigt er keine Symptome – ein Beweis, dass Prävention wirkt.
Leben mit Alzheimer: Praktische Realitäten
Alzheimer verändert nicht nur den Kranken, sondern sein gesamtes Umfeld. Familien stehen vor emotionaler und physischer Erschöpfung. In Deutschland betreuen etwa 1,2 Millionen Menschen ihre Liebsten zu Hause (Statistik 2023). Hier ein tieferer Einblick:
Frühes Stadium: Betroffene nutzen Tagesstrukturen: „Mein Tag“-Kalender (10 Euro), Apps wie „Alzheimer Deutschland“ (kostenlos). Ergotherapie (z. B. Handarbeiten) hilft – etwa 60 % bleiben länger selbstständig (Universität Leipzig, 2022). Eine 68-jährige aus Bremen stickte täglich, was ihr Freude und Struktur gab.
Mittleres Stadium: Sicherheit wird entscheidend: GPS-Tracker (z. B. „Tractive“, 50 Euro) verhindern Verlaufen. Angehörige lernen, Wahnideen zu deeskalieren – z. B. „Ich suche mit dir“ statt Widerspruch. Selbsthilfegruppen (z. B. „Alzheimer Angehörige Bayern“) bieten Schulungen (kostenlos). Ein Beispiel: Frau Meier, 50, aus München, pflegt ihre Mutter. „Sie war Lehrerin, klug und witzig. Jetzt fragt sie ständig nach meinem Vater, der vor 15 Jahren starb. Ich habe gelernt, ruhig zu bleiben, aber es zerreißt mir das Herz.“
Spätes Stadium: Pflegeheime wie „Caritas“ (4.000 Euro/Monat) oder ambulante Dienste (2.500 Euro/Monat) übernehmen. Die Pflegeversicherung deckt bis 2.000 Euro – der Rest ist Eigenanteil. Hospize kommen bei 10 % zum Einsatz (z. B. „Malteser Hospizdienst“). Ein Fall: Herr Becker, 80, aus Berlin, lebte mit seiner Frau, bis sie ihn nicht mehr heben konnte. Ein Pflegeheim wurde nötig – die Familie zahlte 1.800 Euro/Monat dazu.
Tipps für Betroffene (frühe Stadien):
Erinnerungsstützen: Haftnotizen, Wecker, Apps wie „Alzheimer Assistant“.
Routinen vereinfachen: Weniger Entscheidungen – z. B. Kleidung am Abend vorbereiten.
Aktiv bleiben: Spaziergänge, Hobbys wie Malen oder Musik.
Tipps für Angehörige:
Geduld: „Ja, das finden wir später“ statt „Du hast das nie verloren“.
Sicherheit: Scharfe Ecken entfernen, Handläufe anbringen, Herd sichern.
Kommunikation: Kurze Sätze, ruhiger Ton, Augenkontakt.
Hilfe suchen: Pflegekräfte, Selbsthilfegruppen (ca. 1.000 in Deutschland), Sozialdienste.
In Deutschland ist die Pflege eine Mischung aus staatlicher Hilfe (Pflegeversicherung) und privater Initiative. Organisationen wie die „Deutsche Alzheimer Gesellschaft“ bieten Beratung, Schulungen und Hotlines (0800-1110111). Doch die Wartelisten für Pflegeheime sind lang – oft 6-12 Monate –, und viele Familien kämpfen allein. Tagespflege (300 Euro/Monat) entlastet, wird aber nur von 20 % genutzt (Statistik 2023).
Aktuelle Forschung: Der Weg zur Heilung
Die Forschung bietet Hoffnung – hier die neuesten Entwicklungen:
Immuntherapie: Lecanemab (2023) und Donanemab (2024) sind Spitzenreiter. Donanemab reduziert Tau um 50 % (Phase-3-Daten, 2024) – Zulassung in Deutschland möglich 2026. Lecanemab verlangsamte den kognitiven Abbau um 27 % (Clarity-AD-Studie) und wird an der Uniklinik München getestet. Kosten (30.000 Euro/Jahr) und Nebenwirkungen (Hirnödeme bei 15 %) bleiben Hürden. Aducanumab (2021) war der Pionier, doch mit limitiertem Erfolg.
Impfstoffe: ACI-24 (Phase-2, 2024) stimuliert Antikörper gegen Amyloid – bei Mäusen 60 % weniger Plaques (Universität Tübingen, 2023). Ergebnisse für Menschen kommen 2027. UB-311 (seit 2024) zeigt ähnliches Potenzial – erste Daten 2026.
Mikrobiom: Probiotika wie Bifidobacterium reduzieren Entzündungen um 25 % (Universität Magdeburg, 2024) – klinische Studien starten 2026. Eine Studie der Universität Bonn (2023) fand, dass eine gesunde Darmflora Amyloid um 20 % senkt.
Gentherapie: CRISPR-Tests (USA, 2023) reduzieren Amyloid um 20 % – Deutschland plant Versuche 2025 (DZNE). Ziel: APOE4 reparieren oder abschalten.
Neuroprotektoren: NAD+-Booster (Nikotinamid) schützen Neuronen – 25 % weniger Zelltod bei Mäusen (Universität Bonn, 2022). Menschliche Tests starten 2025.
Bis 2040 könnten Kombinationstherapien Alzheimer stoppen – ein Ziel, das die Alzheimer Forschung Initiative (AFI) mit 50 Millionen Euro jährlich unterstützt. In Deutschland forschen Zentren wie die DZNE und die Max-Planck-Institute an vorderster Front. Die Prognose: Bis 2050 könnten die 3 Millionen Betroffenen in Deutschland (Robert Koch-Institut, 2023) durch Prävention und Therapie halbiert werden.
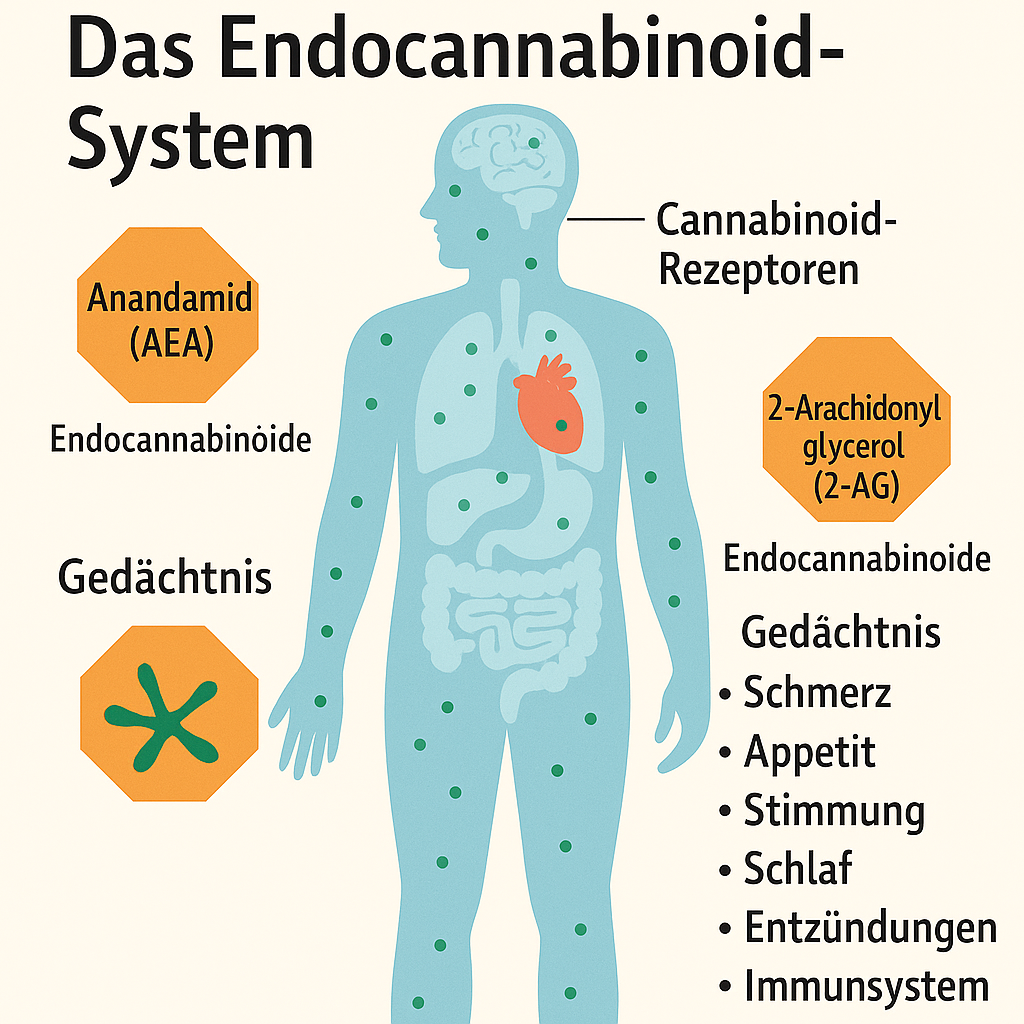
Medizinisches Cannabis bei Alzheimer-Krankheit
Cannabis bzw. einzelne Cannabinoide wie THC und CBD zeigen Potenzial bei:
Symptom Wirkung laut Studien und Berichten
Agitation/Unruhe: Cannabis kann Unruhe, Aggressionen und nächtliches Umherwandern reduzieren.
Appetitlosigkeit THC: regt häufig den Appetit an (z. B. bei kachektischen Alzheimer-Patienten).
Schlafstörungen: Sedierende Sorten (Indica) oder CBD helfen oft beim Einschlafen.
Angst/Depressionen: CBD wirkt anxiolytisch; THC stimmungsaufhellend bei richtiger Dosierung.
Schmerzen: Cannabis wirkt analgetisch und kann z. B. bei begleitender Arthritis helfen.
In diesem Bereich gibt es erste positive Studien und Erfahrungen in Pflegeeinrichtungen, etwa aus Israel, Kanada und Deutschland.
Krankheitsverlauf beeinflussen? (neuroprotektive Wirkung)
In Tiermodellen und Laborexperimenten:
CBD und THC hemmen Beta-Amyloid-Ablagerungen, die für den neuronalen Zerfall bei Alzheimer mitverantwortlich sind.
Entzündungshemmende Eigenschaften von Cannabinoiden könnten die Neurodegeneration verlangsamen.
Antioxidative Effekte: Schutz vor oxidativem Stress, ein weiterer Alzheimer-Treiber.
Studienlage
Shelef et al. (2016, Israel)
THC-reiches Cannabis (Öl) führte bei Alzheimer-Patienten zu einer signifikanten Reduktion von Agitation, Aggression und Wahnvorstellungen.
Walther et al. (2022, Deutschland)
Bei Pflegeheimbewohnern mit Demenz reduzierte Dronabinol (synthetisches THC) die Einnahme von Neuroleptika.
Animal studies (Mucke et al., 2014 / Cheng et al., 2019)
CBD senkte Beta-Amyloid-Werte im Gehirn von Mäusen – vielversprechend, aber noch keine Humanstudie.
Risiken und Kontraindikationen
Verwirrung oder Halluzinationen bei zu hoher THC-Dosis.
Stürze, Kreislaufprobleme, v. a. bei älteren Menschen mit Multimedikation.
Wechselwirkungen mit Psychopharmaka (z. B. Antidepressiva, Neuroleptika) möglich.
Bei fortgeschrittener Demenz nur unter ärztlicher Aufsicht einsetzen.
Autorin: Dr.med Olena Orlova