Polyzystisches Ovarialsyndrom
Polyzystisches Ovarialsyndrom (PCOS): Ursachen, Symptome, Diagnose und Behandlung
Das Polyzystische Ovarialsyndrom (PCOS) ist eine der häufigsten endokrinen Störungen bei Frauen im reproduktiven Alter. Studien zufolge sind 5 bis 10 % der Frauen weltweit betroffen. PCOS zeichnet sich durch ein hormonelles Ungleichgewicht aus, das zu Störungen des Menstruationszyklus, Unfruchtbarkeit und einer Reihe weiterer Symptome führen kann, die die Lebensqualität beeinträchtigen. In diesem Artikel beleuchten wir die wichtigsten Aspekte dieses Zustands: Ursachen, Symptome, Diagnosemethoden und Behandlungsansätze.
Definition
PCOS ist ein komplexer Zustand, bei dem sich in den Eierstöcken zahlreiche kleine Zysten (Follikel, die den Ovulationsprozess nicht abschließen) bilden und der Androgenspiegel (männliche Geschlechtshormone) im Körper einer Frau erhöht ist. Dies führt zu einer Störung der normalen Funktion des Fortpflanzungssystems und des Stoffwechsels. Das Syndrom wurde erstmals 1935 von den amerikanischen Gynäkologen Irving F. Stein und Michael L. Leventhal beschrieben, weshalb es manchmal auch als Stein-Leventhal-Syndrom bezeichnet wird.Es gibt zwei in der klinischen Praxis am häufigsten verwendete Definitionen des polyzystischen Ovarialsyndroms (PCOS).
Die erste Definition wurde 1990 von einem Konsens einer Expertenkommission entwickelt, die vom amerikanischen Nationalen Institut für Gesundheit (NIH) gebildet wurde. Gemäß dieser Definition sollte bei einer Patientin die Diagnose PCOS gestellt werden, wenn gleichzeitig folgende Merkmale vorliegen:
Symptome einer übermäßigen Aktivität oder Sekretion von Androgenen (klinisch und/oder biochemisch);
Oligoovulation oder Anovulation;
und wenn andere Ursachen, die PCOS verursachen könnten, ausgeschlossen wurden.
Die zweite Definition wurde 2003 von einem Konsens europäischer Experten in Rotterdam formuliert. Nach dieser Definition wird die Diagnose gestellt, wenn bei einer Patientin zwei der folgenden drei Merkmale gleichzeitig vorliegen:
Symptome einer übermäßigen Aktivität oder Sekretion von Androgenen (klinisch oder biochemisch);
Oligoovulation oder Anovulation;
polyzystische Ovarien bei einer Ultraschalluntersuchung des Beckens;
und wenn andere Ursachen, die PCOS verursachen könnten, ausgeschlossen wurden.
Die Rotterdam-Definition ist deutlich umfassender und schließt eine wesentlich größere Gruppe von Patientinnen in die Kategorie der Betroffenen ein. Insbesondere umfasst sie auch Patientinnen ohne klinische oder biochemische Anzeichen eines Androgenüberschusses (da nur zwei der drei Merkmale erforderlich sind, nicht alle drei), während bei der amerikanischen Definition ein Überschuss an Androgenen oder deren übermäßige Aktivität eine zwingende Voraussetzung für die Diagnose des PCOS ist. Kritiker der Rotterdam-Definition argumentieren, dass Erkenntnisse, die bei der Untersuchung von Patientinnen mit einem Androgenüberschuss gewonnen wurden, nicht unbedingt auf Patientinnen ohne Symptome eines Androgenüberschusses übertragen werden können.
Ursachen des polyzystischen Ovarialsyndroms (PCOS)
1. Genetische Veranlagung
PCOS weist eine starke familiäre Häufung auf. Studien zeigen, dass 20–40 % der Frauen mit PCOS Verwandte ersten Grades (Mutter oder Schwester) mit diesem Syndrom haben. Dies deutet auf eine genetische Komponente hin, obwohl die genaue Art der Vererbung (autosomal-dominant oder polygen) unklar bleibt.
Kandidatengene:
Genomweite Studien haben Zusammenhänge mit Genen gefunden, die den Androgenstoffwechsel (z. B. CYP11A1, CYP17), Insulinrezeptoren (INSR) und die Regulation von Gonadotropinen (z. B. LHCGR – Rezeptor für luteinisierendes Hormon) beeinflussen. Auch Gene, die Entzündungen und Fettleibigkeit betreffen (z. B. TNF-α), werden untersucht.
Epigenetik:
Epigenetische Veränderungen (z. B. DNA-Methylierung), die durch Umwelteinflüsse während der Schwangerschaft (z. B. Androgenüberschuss) ausgelöst werden, könnten die Entwicklung von PCOS beim Nachwuchs „programmieren“.
Beweise:
Studien an eineiigen Zwillingen zeigen eine höhere Konkordanz (Übereinstimmung der Diagnose) im Vergleich zu zweieigen Zwillingen, was die genetische Grundlage bestätigt.
2. Hyperandrogenismus
Eine übermäßige Produktion von Androgenen ist ein zentrales Element der Pathogenese von PCOS. Androgene werden hauptsächlich von den Ovarien (Theka-Zellen) und in geringerem Maße von den Nebennieren produziert.
Mechanismus:
Ein erhöhter Spiegel an luteinisierendem Hormon (LH) regt die Theka-Zellen der Ovarien zur Synthese von Androgenen (Testosteron und Androstendion) an. Das Verhältnis von LH zu FSH ist bei PCOS-Patientinnen häufig erhöht.
Eine reduzierte Aktivität der Aromatase (ein Enzym, das Androgene in Östrogene umwandelt) in Granulosazellen verhindert die normale Reifung der Follikel, was zu ihrer Atresie (Absterben) und der Anhäufung von Zysten führt.
Klinische Erscheinungen:
Hirsutismus (übermäßiger Haarwuchs), Akne, androgenetische Alopezie und erhöhte Spiegel an freiem Testosteron im Blut.
Nebennierenbeitrag:
Bei etwa 20–30 % der Patientinnen wird der Hyperandrogenismus teilweise durch die Nebennieren verursacht, aufgrund einer erhöhten Aktivität von Enzymen wie der 21-Hydroxylase (ohne dass es sich um eine klassische kongenitale Nebennierenhyperplasie handelt).
3. Insulinresistenz und Hyperinsulinämie
Eine Insulinresistenz wird bei 50–70 % der Frauen mit PCOS festgestellt, unabhängig vom Körpergewicht, wobei Fettleibigkeit diese verschlimmert.
Mechanismus:
Insulinresistenz führt zu einer kompensatorischen Hyperinsulinämie. Überschüssiges Insulin stimuliert direkt die Theka-Zellen der Ovarien zur Produktion von Androgenen über die Aktivierung von Signalwegen (z. B. MAPK).
Insulin reduziert die Produktion von Sexualhormon-bindendem Globulin (SHBG) in der Leber, was den Anteil freier (aktiver) Androgene im Blut erhöht.
Teufelskreis:
Der Hyperandrogenismus verschlechtert wiederum die Insulinsensitivität und verstärkt die metabolischen Störungen.
Beweise:
Frauen mit PCOS haben ein erhöhtes Risiko für das metabolische Syndrom, Typ-2-Diabetes und Herz-Kreislauf-Erkrankungen, was mit der Insulinresistenz zusammenhängt.
4. Hormonelle Dysregulation (Hypothalamus-Hypophysen-Ovarialachse)
Eine Störung der normalen Rückkopplung in diesem System führt zu chronischer Anovulation und polyzystischer Ovarialmorphologie.
Mechanismus:
Der Hypothalamus setzt Gonadotropin-Releasing-Hormon (GnRH) mit erhöhter Impulsfrequenz frei, was die Sekretion von LH durch die Hypophyse im Verhältnis zu FSH erhöht.
Ein niedriger FSH-Spiegel reicht nicht aus, um die Follikel vollständig reifen zu lassen, was zu deren Stillstand im präantralen oder antralen Stadium führt – dies sind die „Zysten“ bei PCOS.
Folgen:
Das Fehlen eines Eisprungs stört die Progesteronproduktion, was zu einer relativen Östrogendominanz und einem Risiko für Endometriumhyperplasie führt.
5. Chronische Entzündung niedrigen Grades
Entzündungen werden als Bindeglied zwischen Fettleibigkeit, Insulinresistenz und Hyperandrogenismus betrachtet.
Mechanismus:
Fettgewebe (insbesondere viszerales Fett) produziert proinflammatorische Zytokine (z. B. TNF-α, IL-6), die die Insulinresistenz verstärken.
Entzündungen können die Ovarien direkt zur Androgenproduktion anregen.
Beweise:
Bei PCOS-Patientinnen sind Entzündungsmarker wie das C-reaktive Protein (CRP) häufig erhöht, insbesondere bei Übergewicht.
6. Umwelt- und Lebensstilfaktoren
Obwohl diese Faktoren nicht die primäre Ursache sind, beeinflussen sie die Schwere der Symptome erheblich.
Fettleibigkeit:
Verstärkt Insulinresistenz und Hyperandrogenismus durch die Zunahme von Fettgewebe, das selbst ein endokrines Organ ist und Östrogene sowie Entzündungsmediatoren produziert.
Ernährung und Lebensstil:
Ein hoher Konsum von Kohlenhydraten mit hohem glykämischen Index kann die Hyperinsulinämie verschärfen. Bewegungsmangel senkt die Insulinsensitivität.
Intrautarine Einflüsse:
Es gibt die Hypothese, dass ein Androgenüberschuss bei der Mutter während der Schwangerschaft (z. B. aufgrund ihres eigenen PCOS) die Entwicklung von PCOS bei der Tochter „programmieren“ könnte.
Zusammenspiel der Faktoren
PCOS entsteht nicht durch eine einzelne Ursache, sondern durch ein komplexes Zusammenspiel der genannten Mechanismen. Zum Beispiel:
Eine genetische Veranlagung kann sich in einer erhöhten Empfindlichkeit der Ovarien gegenüber LH oder Insulin äußern.
Insulinresistenz verstärkt den Hyperandrogenismus, der wiederum den Eisprung stört.
Entzündungen und Fettleibigkeit verschlimmern all diese Prozesse.
Symptome des polyzystischen Ovarialsyndroms (PCOS)
Die Symptome des polyzystischen Ovarialsyndroms (PCOS) sind vielfältig und variieren je nach Patientin abhängig vom Phänotyp (z. B. nach den Rotterdam-Kriterien) und dem Ausmaß der hormonellen und metabolischen Störungen. Sie betreffen das reproduktive, endokrine und metabolische System sowie das äußere Erscheinungsbild und den psychischen Zustand. Im Folgenden finden Sie eine detaillierte Beschreibung der Symptome mit einer Erklärung ihrer Ursachen.
1. Störungen des Menstruationszyklus
Beschreibung:
Unregelmäßige Menstruationen (Oligomenorrhoe – Zyklen länger als 35 Tage oder weniger als 8 Zyklen pro Jahr), Ausbleiben der Menstruation (Amenorrhoe) oder seltene Ovulationen (Oligoovulation). Bei einigen Patientinnen können starke oder schmerzhafte Blutungen auftreten, bedingt durch unregelmäßiges Ablösen der Gebärmutterschleimhaut.
Ursache:
Chronische Anovulation, verursacht durch ein Ungleichgewicht der Gonadotropine (erhöhter LH-Spiegel und Mangel an FSH), stört die Reifung der Follikel und den Eisprung. Das Fehlen eines Eisprungs führt zu einer unzureichenden Produktion von Progesteron, was die Regelmäßigkeit des Zyklus beeinträchtigt.
Häufigkeit:
Tritt bei 70–80 % der Frauen mit PCOS auf.
2. Hyperandrogenismus (klinische und biochemische Manifestationen)
Hyperandrogenismus ist eines der Schlüsselsymptome von PCOS und zeigt sich sowohl äußerlich als auch in Laborwerten.
Hirsutismus:
Beschreibung: Übermäßiges Wachstum terminaler (harter, dunkler) Haare im Gesicht (Schnurrbart, Bart), auf der Brust, dem Rücken, dem Bauch oder den Oberschenkeln nach männlichem Muster.
Ursache: Erhöhte Androgenspiegel (Testosteron, Androstendion) stimulieren die Haarfollikel in androgenempfindlichen Zonen.
Häufigkeit: 60–80 % der Patientinnen.
Akne und fettige Haut:
Beschreibung: Hartnäckige Akne (oft im Gesicht, auf dem Rücken, der Brust) und erhöhte Hautfettigkeit.
Ursache: Androgene steigern die Talgproduktion der Talgdrüsen.
Häufigkeit: 15–30 %.
Androgenetische Alopezie:
Beschreibung: Ausdünnung und Haarausfall auf dem Kopf, insbesondere im Scheitelbereich, nach männlichem Muster.
Ursache: Empfindlichkeit der Haarfollikel der Kopfhaut gegenüber Androgenen (insbesondere Dihydrotestosteron).
Häufigkeit: 5–15 %.
Biochemischer Hyperandrogenismus:
Beschreibung: Erhöhte Spiegel von Gesamt- oder freiem Testosteron, Androstendion oder Dehydroepiandrosteron-Sulfat (DHEA-S) im Blut.
Ursache: Übermäßige Produktion von Androgenen durch die Ovarien und/oder Nebennieren sowie eine Verringerung des SHBG (Sexualhormon-bindendes Globulin) aufgrund von Hyperinsulinämie.
3. Polyzystische Ovarialmorphologie
Beschreibung:
Bei der Ultraschalluntersuchung (US) des Beckens zeigen sich Ovarien mit multiplen kleinen Follikeln (üblicherweise mehr als 12–20 Follikel mit einem Durchmesser von 2–9 mm pro Ovar) und/oder ein vergrößertes Ovarialvolumen (>10 cm³).
Ursache:
Stillstand des Follikelwachstums in frühen Stadien aufgrund eines Mangels an FSH und eines Überschusses an LH. Diese Follikel reifen nicht vollständig und ovulieren nicht, was das charakteristische „polyzystische“ Bild erzeugt.
Häufigkeit:
Tritt bei 60–80 % der Patientinnen auf, ist jedoch nach den NIH-Kriterien kein zwingendes Diagnosekriterium.
4. Unfruchtbarkeit
Beschreibung:
Schwierigkeiten bei der Empfängnis aufgrund seltener oder ausbleibender Ovulationen.
Ursache:
Chronische Anovulation verhindert den Austritt einer Eizelle, der für eine Befruchtung notwendig ist. Selbst bei erhaltenen Menstruationen kann die Ovulation fehlen (anovulatorische Zyklen).
Häufigkeit:
PCOS ist eine der Hauptursachen für weibliche Unfruchtbarkeit und betrifft 70–80 % der Frauen mit anovulatorischer Infertilität.
5. Metabolische Störungen
Fettleibigkeit:
Beschreibung: Übermäßiges Körpergewicht, oft mit bevorzugter Fettansammlung im Bauchbereich (viszerale Adipositas).
Ursache: Insulinresistenz und Hyperinsulinämie fördern die Fettansammlung, während Fettleibigkeit diese Störungen verschlimmert.
Häufigkeit: 40–60 %, obwohl PCOS auch bei Frauen mit normalem Gewicht auftritt.
Insulinresistenz:
Beschreibung: Verminderte Empfindlichkeit der Gewebe gegenüber Insulin, was sich in erhöhten Glukose- oder Insulinspiegeln im Blut zeigen kann.
Ursache: Störung der Insulinsignalwege, möglicherweise genetisch bedingt.
Häufigkeit: 50–70 %.
Acanthosis nigricans:
Beschreibung: Dunkle, samtige Hautflecken (in den Achselhöhlen, am Hals, in der Leistengegend).
Ursache: Hyperinsulinämie regt die Proliferation von Keratinozyten und Fibroblasten in der Haut an.
Häufigkeit: 5–20 %.
6. Reproduktive Komplikationen
Risiko von Schwangerschaftskomplikationen:
Beschreibung: Erhöhte Wahrscheinlichkeit von Fehlgeburten, Schwangerschaftsdiabetes, Präeklampsie und Frühgeburten bei Frauen mit PCOS.
Ursache: Hormonelles Ungleichgewicht (Hyperandrogenismus, Progesteronmangel) und metabolische Störungen.
Endometriumhyperplasie:
Beschreibung: Verdickung der Gebärmutterschleimhaut, manchmal mit einem Risiko für Endometriumkarzinom.
Ursache: Chronische Exposition gegenüber Östrogenen ohne Gegenwirkung von Progesteron aufgrund von Anovulation.
7. Psychoemotionale Symptome
Beschreibung:
Depression, Angstzustände, geringes Selbstwertgefühl, Essstörungen.
Ursache:
Physiologisch: Hormonelle Veränderungen (z. B. Hyperandrogenismus) können Neurotransmitter wie Serotonin beeinflussen.
Psychologisch: Äußere Erscheinungen (Hirsutismus, Akne, Fettleibigkeit) und Unfruchtbarkeit wirken sich negativ auf die Lebensqualität aus.
Häufigkeit:
Depressionen treten bei 30–50 % der Patientinnen auf, Angstzustände bei 20–40 %.
8. Andere mögliche Symptome
Chronische Beckenschmerzen:
Selten, möglicherweise mit vergrößerten Ovarien oder entzündlichen Prozessen verbunden.
Schlafapnoe:
Häufiger bei Patientinnen mit Fettleibigkeit, im Zusammenhang mit dem metabolischen Syndrom.
Hyperpigmentierung:
Neben Acanthosis nigricans können aufgrund von Insulinresistenz auch andere Hautveränderungen auftreten.
Variabilität der Symptome
Die Symptome von PCOS unterscheiden sich in ihrer Ausprägung und Kombination:
Bei einigen Patientinnen dominiert der Hyperandrogenismus (Hirsutismus, Akne), der Zyklus kann jedoch regelmäßig sein.
Bei anderen stehen Unfruchtbarkeit und unregelmäßige Menstruationen im Vordergrund, ohne deutliche äußere Anzeichen eines Androgenübersusses.
Bei einer dritten Gruppe überwiegen metabolische Störungen (Fettleibigkeit, Insulinresistenz).
Diese Heterogenität erklärt, warum die Rotterdam-Kriterien ein breiteres Spektrum an Patientinnen umfassen als die NIH-Kriterien. Diagnose und Behandlung werden individuell angepasst, unter Berücksichtigung der vorherrschenden Symptome.Gesundheitsrisiken und Komplikationen
Frauen, die am polyzystischen Ovarialsyndrom (PCOS) leiden, sind einem erhöhten Risiko für die Entwicklung folgender Komplikationen ausgesetzt:
Endometriumhyperplasie und Endometriumkarzinom:
Dies resultiert aus dem Ausbleiben oder der Unregelmäßigkeit der Menstruation und der „Ansammlung“ von nicht abgeschilfertem Endometrium sowie aus dem Fehlen oder der Unzulänglichkeit von Progesteronwirkungen, was zu einer langfristigen, durch Progesteron nicht ausgeglichenen Hyperstimulation der Endometriumzellen durch erhöhte Östrogenspiegel führt.
Brustkrebs:
Ein erhöhtes Risiko wird diskutiert, obwohl die Daten hierzu nicht eindeutig sind.
Fettleibigkeit:
Übermäßiges Körpergewicht, insbesondere viszerale Adipositas, ist häufig und verstärkt andere Risiken.
Insulinresistenz und Typ-2-Diabetes:
Die gestörte Insulinwirkung erhöht die Wahrscheinlichkeit für Diabetes mellitus.
Erhöhter Blutdruck:
Hypertonie tritt häufiger auf, oft im Zusammenhang mit metabolischen Störungen.
Thrombosen, Thrombembolien, Thrombophlebitis:
Diese entstehen durch eine erhöhte Blutgerinnungsfähigkeit, die mit PCOS assoziiert sein kann.
Dyslipidämie:
Störungen im Cholesterin- und Triglyceridstoffwechsel können zur Entwicklung von Atherosklerose der Blutgefäße führen.
Herz-Kreislauf-Erkrankungen, Herzinfarkt, Schlaganfall:
Die Kombination aus Dyslipidämie, Hypertonie und Insulinresistenz erhöht das Risiko für kardiovaskuläre Ereignisse.
Diagnose des polyzystischen Ovarialsyndroms (PCOS)
Die Diagnose des polyzystischen Ovarialsyndroms (PCOS) ist ein mehrstufiger Prozess, der die Bewertung klinischer Symptome, Laborwerte und instrumenteller Untersuchungen umfasst. Sie basiert auf international anerkannten Kriterien (z. B. NIH 1990 oder Rotterdam 2003) und erfordert den Ausschluss anderer Erkrankungen mit ähnlichen Symptomen. Im Folgenden wird der Diagnoseprozess detailliert beschrieben.
1. Anamnese und Bewertung klinischer Symptome
Der erste Schritt ist eine gründliche Befragung der Patientin, um charakteristische Beschwerden und Risikofaktoren zu identifizieren.
Menstruationszyklus:
Fragen: Unregelmäßige Menstruationen (Zyklen >35 Tage oder <8 pro Jahr), Amenorrhoe (Ausbleiben der Menstruation über mehr als 3 Monate), starke oder schmerzhafte Blutungen.
Bedeutung: Hinweis auf Oligo- oder Anovulation – ein Schlüsselsymptom von PCOS.
Zeichen von Hyperandrogenismus:
Fragen: Vorhandensein von Hirsutismus (übermäßiger Haarwuchs), Akne, androgenetischer Alopezie.
Bewertung: Verwendung der Ferriman-Gallwey-Skala für Hirsutismus (bewertet Haarwuchs in 9 Körperregionen; >8 Punkte – Hinweis auf Hyperandrogenismus).
Reproduktive Probleme:
Fragen: Schwierigkeiten bei der Empfängnis, Fehlgeburten in der Vorgeschichte.
Bedeutung: Bestätigt eine mögliche Anovulation.
Metabolische Symptome:
Fragen: Gewichtszunahme, insbesondere im Bauchbereich, dunkle Hautflecken (Acanthosis nigricans).
Bedeutung: Hinweis auf Insulinresistenz.
Familienanamnese:
Fragen: Vorkommen von PCOS, Typ-2-Diabetes oder Herz-Kreislauf-Erkrankungen bei Verwandten.
Bedeutung: Unterstützt die Hypothese einer genetischen Prädisposition.
2. Körperliche Untersuchung
Die Untersuchung hilft, klinische Zeichen von PCOS zu bestätigen und andere Pathologien auszuschließen.
Bewertung des Hirsutismus:
Visuelle Skala (z. B. Ferriman-Gallwey). Die Lokalisation des Haarwuchses (Gesicht, Brust, Bauch) ist wichtig, um andere Ursachen für Hyperandrogenismus (z. B. Tumore) auszuschließen.
Hautveränderungen:
Überprüfung auf Akne, fettige Haut, Acanthosis nigricans (dunkle Bereiche in Hautfalten).
Body-Mass-Index (BMI):
Messung von Gewicht und Größe zur Bewertung von Fettleibigkeit (BMI >30 kg/m² – Adipositas).
Blutdruck:
Erhöhter Blutdruck (>130/85 mmHg) kann auf ein metabolisches Syndrom hinweisen.
Untersuchung der Schilddrüse:
Vergrößerung oder Knoten können auf eine Hypothyreose hindeuten, die ausgeschlossen werden muss.
3. Laboruntersuchungen
Labortests bestätigen Hyperandrogenismus, Insulinresistenz und schließen alternative Diagnosen aus.
Hormonprofil:
Testosteron (gesamt und frei): Erhöhter Spiegel bestätigt Hyperandrogenismus. Freies Testosteron ist sensitiver, da SHBG bei PCOS oft reduziert ist.
Dehydroepiandrosteron-Sulfat (DHEA-S): Erhöhung deutet auf eine Nebennierenquelle der Androgene hin.
Luteinisierendes Hormon (LH) und Follikelstimulierendes Hormon (FSH): Ein LH/FSH-Verhältnis >2–3 ist bei PCOS häufig, aber kein zwingendes Kriterium.
Östradiol und Progesteron: Niedriges Progesteron in der Zyklusmitte bestätigt Anovulation.
Prolaktin: Mäßige Erhöhung (<50 ng/ml) ist bei PCOS möglich, starke Erhöhung (>100 ng/ml) erfordert den Ausschluss eines Prolaktinoms.
Thyreotropin (TSH) und freies T4: Zum Ausschluss einer Hypothyreose.
Cortisol oder 17-Hydroxyprogesteron (17-OHP): Erhöhung schließt Cushing-Syndrom oder kongenitale Nebennierenhyperplasie (CAH) aus.
Metabolische Marker:
Nüchtern-Glukose und Glukosetoleranztest (GTT): Diagnose von Prädiabetes oder Typ-2-Diabetes.
Nüchtern-Insulin: Erhöhung deutet auf Insulinresistenz hin. Der HOMA-IR-Index (>2,5) wird häufig zur Bewertung verwendet.
Lipidprofil: Erhöhte Triglyceride, niedriges HDL („gutes“ Cholesterin) und hohes LDL deuten auf Dyslipidämie hin.
Zusätzlich:
Anti-Müller-Hormon (AMH): Hoher Spiegel (>4–5 ng/ml) spiegelt eine große Anzahl kleiner Follikel wider und korreliert mit polyzystischer Ovarialmorphologie.
4. Instrumentelle Methoden
Ultraschalluntersuchung (US) des Beckens:
Was wird bewertet:
Anzahl der Follikel (≥12–20 Follikel mit 2–9 mm Durchmesser in einem Ovar).
Ovarialvolumen (>10 cm³).
Fehlen eines dominanten Follikels oder Corpus luteum (Hinweis auf Anovulation).
Methode: Transvaginaler Ultraschall ist wegen höherer Genauigkeit bevorzugt, durchgeführt am 3.–5. Zyklustag (falls ein Zyklus vorhanden ist).
Bedeutung: Bestätigt polyzystische Ovarialmorphologie (nach Rotterdam-Kriterien). Bei 20–30 % gesunder Frauen können jedoch ähnliche Befunde auftreten, weshalb der Ultraschall kein alleiniges Kriterium ist.
Zusätzlich (bei Bedarf):
MRT oder CT der Nebennieren/Hypophyse: Zum Ausschluss von Tumoren bei atypischen Hormonwerten (z. B. stark erhöhtes DHEA-S oder Prolaktin).
5. Diagnosekriterien
Die Diagnose von PCOS basiert auf zwei Hauptansätzen:
NIH-Kriterien (1990):
Erforderlich sind beide Merkmale:
1. Hyperandrogenismus (klinisch oder biochemisch).
2. Oligo- oder Anovulation.
Der Ausschluss anderer Ursachen ist zwingend erforderlich.
Rotterdam-Kriterien (2003):
Erforderlich sind 2 von 3 Merkmalen:
1. Hyperandrogenismus (klinisch oder biochemisch).
2. Oligo- oder Anovulation.
3. Polyzystische Ovarialmorphologie im Ultraschall.
Der Ausschluss anderer Ursachen ist ebenfalls notwendig.
Ausschluss anderer Erkrankungen:
Hypothyreose (TSH erhöht, T4 erniedrigt).
Hyperprolaktinämie (Prolaktin >50–100 ng/ml).
CAH (17-OHP >2 ng/ml, bestätigt durch ACTH-Test).
Cushing-Syndrom (Cortisol erhöht, positiver Dexamethason-Test).
Androgenproduzierende Tumore (stark erhöhtes Testosteron >200 ng/dl).
6. Differentialdiagnose
PCOS muss von Zuständen mit ähnlichen Symptomen unterschieden werden:
Hypothyreose: Müdigkeit, Gewichtszunahme, aber keine polyzystischen Ovarien im Ultraschall.
Hyperprolaktinämie: Unregelmäßige Zyklen, Galaktorrhö, hohes Prolaktin.
CAH: Hirsutismus, aber mit Zeichen der Virilisierung (raue Stimme, Klitoromegalie).
Ovarial-/Nebennierentumore: Schneller Symptombeginn, extrem hohes Testosteron.
7. Besonderheiten der Diagnose
Alter: Bei Jugendlichen ist die Diagnose schwieriger, da unregelmäßige Zyklen und Akne physiologisch sein können. Rotterdam-Kriterien werden vorsichtig angewendet.
Ethnische Unterschiede: Hirsutismus ist bei Frauen mediterraner Herkunft stärker ausgeprägt, was die Bewertung beeinflusst.
Falsch-positive Ergebnisse: Polyzystische Ovarien im Ultraschall können bei gesunden Frauen vorkommen, hohes AMH auch bei anderen Pathologien.
Therapie
Historisch gesehen bestanden die ersten Versuche zur Behandlung des polyzystischen Ovarialsyndroms in chirurgischen Eingriffen – der Dekapsulation der Ovarien oder ihrer partiellen Resektion mit Entfernung der am stärksten von Zysten betroffenen Gewebebereiche, der sogenannten „ovarian wedge resection“ (Keilresektion der Ovarien) oder der vorsichtigen Anwendung von Diathermie (Erwärmung) der Ovarien. In einigen Fällen führten solche Operationen zum Erfolg und ermöglichten die Wiederherstellung der Fruchtbarkeit der Frau, eine deutliche Reduktion der Androgensekretion durch die Ovarien, die Normalisierung des Menstruationszyklus und mehr. Allerdings war ein chirurgischer Eingriff nicht immer möglich und nicht immer erfolgreich. Zudem konnten Komplikationen wie die Bildung von Adhäsionen (Verklebungen) auftreten. Daher suchten Fachleute nach konservativen, nicht-chirurgischen Behandlungsmethoden für PCOS.
Die traditionelle konservative Behandlung bestand in der Verabreichung von Antiandrogenen, Östrogenen, Progestinen mit antiandrogener Wirkung oder deren Kombination (z. B. in Form von Verhütungspillen wie Diane-35). Diese Behandlung normalisierte in der Regel den Menstruationszyklus, war jedoch bei Hautsymptomen (Akne, fettige Haut, androgenabhängiger Haarausfall) nur unzureichend wirksam, konnte weder Ovulation noch Fruchtbarkeit wiederherstellen und beseitigte nicht die eigentlichen Ursachen des PCOS (Störungen der Insulinsekretion, der Insulinempfindlichkeit der Gewebe, der Funktion der Hypothalamus-Hypophysen-Achse usw.). Darüber hinaus ging die Behandlung mit Östrogenen, Progestinen und Antiandrogenen häufig mit einer weiteren Gewichtszunahme der Patientinnen einher, verschlimmerte bestehende Probleme mit dem Kohlenhydratstoffwechsel und der Schilddrüse, führte zu Hyperprolaktinämie und Depressionen.
Ein weiterer Versuch, die Behandlungsmethoden für PCOS zu verbessern, wurde mit der Einführung antiöstrogen wirkender Medikamente wie Clomifencitrat (Clostilbegyt) und Tamoxifen unternommen. Die Anwendung von Clomifencitrat oder Tamoxifen in der Zyklusmitte führte in etwa 30 % der Fälle erfolgreich zur Induktion der Ovulation, stellte die Fruchtbarkeit der Frauen wieder her und ermöglichte einen stabilen ovulatorischen Menstruationszyklus ohne die Verwendung exogener Hormone (Östrogene, Progestine, Antiandrogene). Die Wirksamkeit von Clomifencitrat und Tamoxifen in Bezug auf andere PCOS-Symptome, insbesondere die Manifestationen des Hyperandrogenismus, blieb jedoch begrenzt. Die kombinierte Therapie (Östrogene und Progestine oder Antiandrogene im Zyklus, Clomifencitrat oder Tamoxifen in der Zyklusmitte) war wirksamer, aber ebenfalls nicht ausreichend.
Versuche, die Behandlungseffizienz bei Frauen mit PCOS durch die Korrektur nachweislich vorhandener oder vermuteter begleitender endokriner Störungen zu verbessern (z. B. Korrektur einer begleitenden Hyperprolaktinämie mit Bromocriptin, einer subklinischen Schilddrüseninsuffizienz mit Schilddrüsenhormonen, Unterdrückung der Hypersekretion von Nebennierenandrogenen mit niedrigen Dosen Dexamethason), waren teilweise erfolgreich, jedoch war der Erfolg individuell und nicht ausreichend konstant oder vorhersehbar.
Wirkliche Fortschritte in der Behandlungseffizienz von PCOS wurden erzielt, als ein tieferes Verständnis der Pathogenese des Syndroms erreicht wurde und der Hypersekretion von Insulin sowie der pathologischen Insulinresistenz der Gewebe bei erhaltener Insulinempfindlichkeit der Ovarien eine primäre Bedeutung beigemessen wurde. Seitdem wurden Medikamente, die die Insulinempfindlichkeit der Gewebe normalisieren und die Insulinsekretion senken – Metformin und Glitazone (Pioglitazon, Rosiglitazon) – als Mittel der ersten Wahl zur Behandlung von PCOS weit verbreitet eingesetzt. Dieser Ansatz erwies sich als sehr erfolgreich: Bei 80 % der Frauen mit PCOS stellte sich unter Monotherapie mit Metformin oder einem der Glitazone spontan die Ovulation wieder ein, der Menstruationszyklus normalisierte sich, die Androgensekretion der Ovarien nahm ab, Symptome des Hyperandrogenismus verschwanden oder wurden reduziert, das Körpergewicht sank, der Kohlenhydratstoffwechsel normalisierte sich und der psychische Zustand verbesserte sich. Die meisten dieser Frauen konnten anschließend gesunde Kinder austragen und gebären.
Ein noch höherer Erfolgsprozentsatz, der über 90 % lag, wurde durch eine kombinierte Therapie erreicht – die Kombination von Metformin oder Glitazonen mit bereits bekannten Methoden (Östrogenen, Antiandrogenen und Progestinen und/oder Antiöstrogenen in der Zyklusmitte und/oder möglicherweise der Korrektur begleitender Störungen der Prolaktinsekretion, Schilddrüsenhormone oder Nebennierenandrogene). Die Einführung dieses kombinierten Ansatzes in die Praxis von Gynäkologen-Endokrinologen machte chirurgische Eingriffe bei PCOS nahezu überflüssig – außer in seltenen, polyresistenten Fällen – und reduzierte die Notwendigkeit der Ovulationsinduktion mit Gonadotropinen sowie der künstlichen Befruchtung bei Frauen mit PCOS erheblich.
Heutzutage sind Metformin und Glitazone (Pioglitazon, Rosiglitazon) die Mittel der ersten Wahl bei der Behandlung von PCOS. Bei Bedarf können antiandrogene Medikamente (Cyproteronacetat), Östrogene (Ethinylestradiol als Einzelpräparat oder in Verhütungspillen), Progestine oder niedrige Dosen Dexamethason (0,5–1 mg abends zur Unterdrückung der Nebennierenandrogensekretion) hinzugefügt werden.
Maßnahmen zur Normalisierung des Körpergewichts sind erforderlich: Diät und körperliche Aktivität.
Ein vielversprechender Ansatz für eine effektive und sichere Therapie von PCOS ist die Verwendung von Nutraceuticals, insbesondere Myo-Inositol. Myo-Inositol und seine Derivate sind für die Wirkung von GnRH, LH und FSH notwendig. Die Effekte von Myo-Inositol bei Frauen mit PCOS wurden in einer systematischen Analyse randomisierter kontrollierter Studien untersucht. Insgesamt sprechen die Ergebnisse der Analyse für die Empfehlung von Myo-Inositol zur Verbesserung der Ovarialfunktion sowie der metabolischen und hormonellen Parameter bei Patientinnen mit PCOS.
Bei Vorliegen einer begleitenden Hyperprolaktinämie ist deren Korrektur durch die Verabreichung von Bromocriptin indiziert. Bei Nachweis einer subklinischen oder gar klinisch manifesten Schilddrüseninsuffizienz sollte diese durch die Verabreichung von exogenem L-Thyroxin korrigiert werden.
Falls eine Ovulationsinduktion erforderlich ist und diese nicht spontan unter der Therapie mit Metformin oder Glitazonen eintritt, können der Patientin Clomifencitrat oder Tamoxifen in der Zyklusmitte verordnet werden.
Bei Resistenz gegen alle angewandten Behandlungsmethoden ist ein chirurgischer Eingriff indiziert (Laser- oder Diathermokoagulation der Ovarien, Dekapsulation oder partielle Resektion).
Eine randomisierte, doppelt verblindete, placebokontrollierte klinische Studie am Menschen zeigte, dass die Einnahme von Nachtkerzenöl (1000 mg/Tag) über 12 Wochen die Regulierung des Menstruationszyklus bei jugendlichen Mädchen mit PCOS förderte.
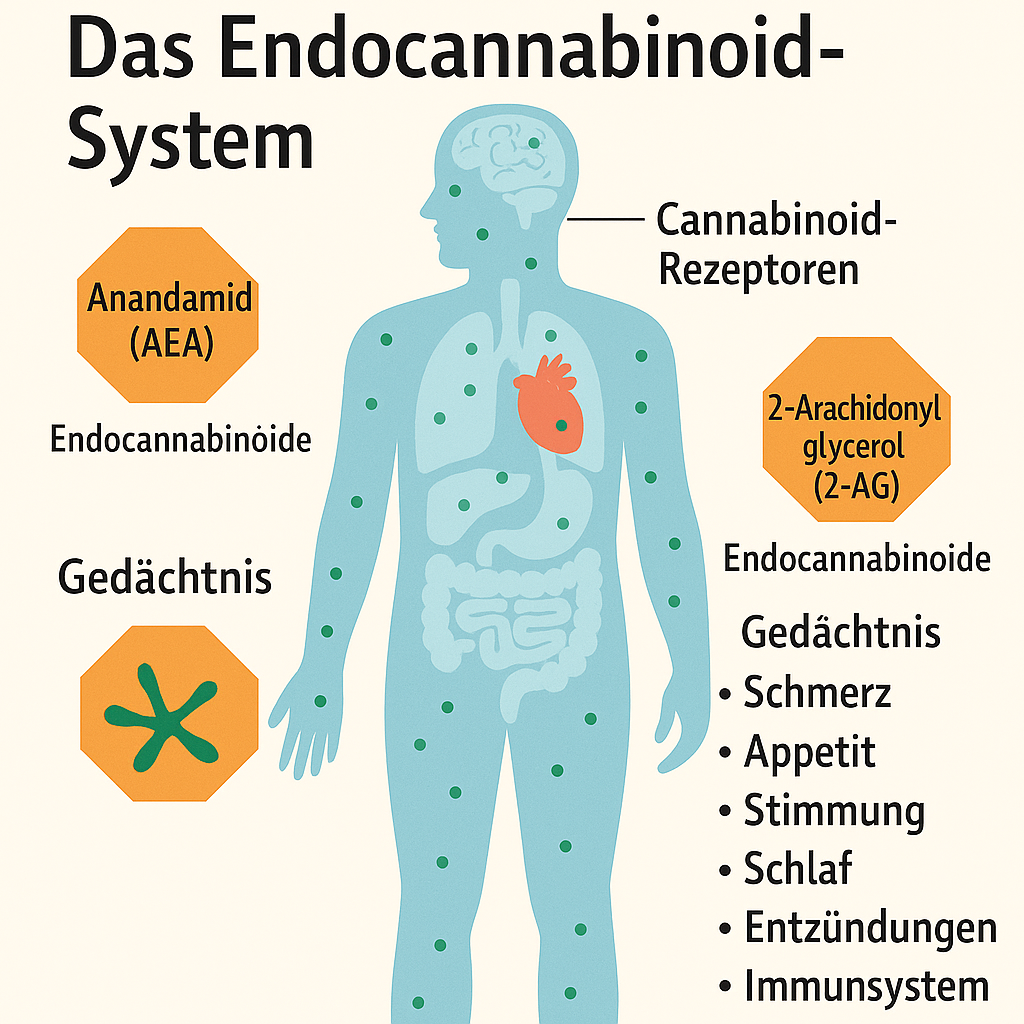
Medizinisches Cannabis
wird zunehmend als ergänzende Therapie bei verschiedenen chronischen Erkrankungen eingesetzt, darunter auch hormonelle und entzündliche Erkrankungen wie das Polyzystische Ovarialsyndrom (PCOS).
Schmerzlinderung
Viele PCOS-Betroffene leiden unter chronischen Unterleibsschmerzen oder starken Menstruationsbeschwerden. Cannabinoide wie THC und CBD können über das Endocannabinoid-System schmerzlindernd wirken.
Entzündungshemmung
PCOS ist mit niedriggradigen chronischen Entzündungen verbunden. Cannabinoide, besonders CBD, zeigen entzündungshemmende Effekte, die zur Linderung beitragen könnten.
Regulation des Hormonhaushalts
Das Endocannabinoid-System ist in hormonelle Regelkreise eingebunden. Es gibt Hinweise darauf, dass es indirekt den Hormonhaushalt beeinflussen kann – etwa durch Modulation der Hypothalamus-Hypophysen-Gonaden-Achse. Konkrete Daten zu Cannabis und Androgenspiegel bei PCOS fehlen aber noch.
Verbesserung des Schlafs
Depressionen, Angstzustände und Schlafprobleme sind bei PCOS häufig. CBD kann angstlösend und schlaffördernd wirken, während THC kurzfristig stimmungsaufhellend sein kann.
Autorin: Dr.med Olena Orlova