HIV
HIV (Humanes Immundefizienz-Virus) ist eines der am intensivsten erforschten und gleichzeitig komplexesten Viren, mit denen die Menschheit konfrontiert ist. Es greift das Immunsystem an und zerstört nach und nach dessen Fähigkeit, den Körper vor Krankheiten zu schützen. Ohne Behandlung kann HIV zu AIDS (Erworbenes Immundefizienz-Syndrom) fortschreiten, einer Phase, in der selbst geringfügige Infektionen lebensbedrohlich werden. Doch die Fortschritte der Medizin des 21. Jahrhunderts haben HIV von einer unheilbaren Krankheit in eine chronische Erkrankung verwandelt, mit der man bei Einhaltung ärztlicher Empfehlungen Jahrzehnte lang leben kann.
Was ist HIV?
HIV gehört zur Familie der Retroviren. Seine Besonderheit liegt in der Fähigkeit, seine genetische Information in die DNA menschlicher Zellen einzubauen, was es extrem schwierig macht, es vollständig zu eliminieren. Es gibt zwei Haupttypen: HIV-1, das weltweit verbreitet ist, und HIV-2, das vor allem in Westafrika vorkommt. HIV-1 ist aggressiver und verantwortlich für die meisten Infektionen.
Sobald es in den Körper gelangt, greift HIV die CD4-Lymphozyten an – Schlüsselmoleküle des Immunsystems, die die Abwehr von Infektionen koordinieren. Das Virus nutzt diese Zellen als „Fabriken“ zur Vermehrung und zerstört sie dabei. Mit der Zeit nimmt die Anzahl der CD4-Zellen ohne Behandlung ab, bis das Immunsystem so geschwächt ist, dass es Krankheiten nicht mehr abwehren kann.
Wie wird HIV übertragen?
HIV wird ausschließlich über bestimmte Körperflüssigkeiten übertragen, die eine ausreichende Viruskonzentration enthalten. Dazu gehören Blut, Sperma, Präejakulat, Vaginalsekret und Muttermilch. Die Hauptübertragungswege sind:
1. Geschlechtsverkehr. Ungeschützter Sex (vaginal, anal oder oral) mit einer HIV-infizierten Person ist der häufigste Übertragungsweg. Das Risiko steigt bei Vorliegen anderer sexuell übertragbarer Infektionen (z. B. Herpes oder Syphilis), die Mikroverletzungen an den Schleimhäuten verursachen.
2. Kontakt mit infiziertem Blut. Die gemeinsame Nutzung von Spritzen, Nadeln oder schlecht sterilisierten medizinischen Instrumenten ist eine häufige Ursache unter Menschen, die injizierbare Drogen konsumieren. Bluttransfusionen mit infiziertem Blut sind heutzutage dank strenger Kontrollen selten.
3. Von Mutter zu Kind. Das Virus kann während der Schwangerschaft, Geburt oder durch Stillen übertragen werden. Bei richtiger Behandlung der Mutter sinkt das Risiko jedoch auf unter 1 %.
4. Berufliche Risiken. Medizinisches Personal kann sich durch versehentliche Nadelstiche mit infiziertem Blut anstecken, obwohl solche Fälle dank strenger Sicherheitsprotokolle selten sind.
Wichtig ist zu verstehen, dass HIV nicht über Luft, Wasser, Speichel (sofern kein Blut darin ist), Schweiß, Tränen, Insektenstiche oder alltägliche Kontakte (Umarmungen, Händeschütteln, gemeinsames Geschirr) übertragen wird.
Forschungen zeigen, dass HIV drei Hauptphasen durchläuft: akute Infektion, chronische Infektion und AIDS.
Jede Phase hat ihre eigenen Symptome, Dauer und Übertragungsrisiken.
Eine frühzeitige Behandlung mit antiretroviraler Therapie (ART) kann den Fortschritt verlangsamen und die Lebensqualität verbessern.
Regelmäßige Tests sind wichtig, insbesondere wenn nach einer möglichen Infektion grippeähnliche Symptome auftreten.
Phasen der HIV-Entwicklung
Akute HIV-Infektion
Dies ist die Anfangsphase, die normalerweise 2–4 Wochen nach der Infektion beginnt. Das Virus vermehrt sich schnell, und der Virusgehalt im Blut ist sehr hoch, was das Übertragungsrisiko erhöht. Einige Menschen erleben grippeähnliche Symptome wie Fieber, Kopfschmerzen, Hautausschlag und Halsschmerzen. Die Symptome können jedoch mild oder gar nicht vorhanden sein.
Chronische HIV-Infektion
Diese Phase, auch klinische Latenz genannt, kann Jahre dauern, im Durchschnitt 8–10 Jahre ohne Behandlung. Das Virus vermehrt sich weiter, jedoch auf einem niedrigen Niveau, und viele Menschen haben keine Symptome. Ohne Behandlung kann diese Phase in AIDS übergehen. Mit ART kann diese Phase Jahrzehnte andauern, und das Übertragungsrisiko sinkt auf null, wenn das Virus nicht nachweisbar ist.
AIDS
Dies ist die schwerste Phase, in der das Immunsystem stark geschädigt ist. Die Diagnose wird gestellt, wenn die CD4-Zellzahl unter 200 Zellen pro Kubikmillimeter Blut fällt oder bestimmte Infektionen wie Pneumonie auftreten. Ohne Behandlung beträgt die Überlebensdauer etwa 3 Jahre, aber ART kann den Zustand verbessern.
Detaillierte Beschreibung der HIV-Entwicklungsphasen
In diesem Abschnitt wird eine detaillierte Beschreibung der HIV-Entwicklungsphasen gegeben, basierend auf Informationen aus verlässlichen Quellen wie den National Institutes of Health (NIH), den Centers for Disease Control and Prevention (CDC) und Healthline. Diese Informationen decken Symptome, Dauer, Übertragungsrisiko und die Bedeutung der Behandlung ab und bieten einen vollständigen Überblick für ein besseres Verständnis des Prozesses.
Allgemeine Informationen über HIV
HIV (Humanes Immundefizienz-Virus) greift CD4-Zellen an und zerstört sie, die ein wichtiger Teil des Immunsystems sind und den Körper vor Infektionen schützen. Ohne Behandlung durchläuft HIV drei Hauptphasen: akute Infektion, chronische Infektion und AIDS. Mit moderner antiretroviraler Therapie (ART) kann der Fortschritt jedoch erheblich verlangsamt werden, und der Virusgehalt im Blut kann auf ein nicht nachweisbares Niveau gesenkt werden, wodurch das Übertragungsrisiko eliminiert wird.
Detaillierte Beschreibung der Phasen
Akute HIV-Infektion
Beschreibung: Dies ist die Anfangsphase, die sich innerhalb von 2–4 Wochen nach der Infektion entwickelt. Während dieser Phase vermehrt sich HIV schnell, und die Viruslast im Blut erreicht ihren Höhepunkt. Das Virus greift aktiv CD4-Zellen an und zerstört sie, wodurch das Immunsystem verwundbar wird.
Symptome: Einige Menschen erleben grippeähnliche Symptome wie Fieber, Kopfschmerzen, Hautausschlag, Halsschmerzen, Schüttelfrost und geschwollene Lymphknoten. Bei vielen sind die Symptome jedoch absent oder so mild, dass sie für eine gewöhnliche Erkältung gehalten werden.
Dauer: Diese Phase dauert normalerweise einige Wochen, bis der Körper beginnt, Antikörper zu produzieren (Serokonversion).
Übertragungsrisiko: Das Risiko, HIV zu übertragen, ist in dieser Phase aufgrund der hohen Viruslast sehr hoch. Dies ist die Zeit, in der eine Person am ansteckendsten ist.
Bedeutung früher Behandlung: Der Beginn der ART in dieser Phase kann erhebliche gesundheitliche Vorteile bringen, die Schädigung des Immunsystems verlangsamen und das Übertragungsrisiko reduzieren.
Chronische HIV-Infektion (Klinische Latenz)
Beschreibung: Nach der akuten Phase geht HIV in eine chronische Phase über, auch asymptomatische Infektion oder klinische Latenz genannt. In dieser Phase vermehrt sich das Virus weiter, jedoch auf einem viel niedrigeren Niveau. Das Immunsystem wird allmählich geschädigt, aber der Prozess ist langsam, und viele Menschen fühlen sich gut.
Symptome: Die meisten Menschen haben keine offensichtlichen HIV-bezogenen Symptome, obwohl einige geschwollene Lymphknoten oder leichte Müdigkeit haben können. Diese Phase wird oft als asymptomatisch bezeichnet, aber das Virus bleibt aktiv und infiziert weiterhin neue Zellen.
Dauer: Ohne Behandlung kann diese Phase im Durchschnitt 8–10 Jahre dauern, wobei die Dauer je nach allgemeinem Gesundheitszustand, Lebensstil und anderen Faktoren variiert. Mit effektiver ART kann diese Phase Jahrzehnte andauern, und ein Übergang zu AIDS kann verhindert werden.
Übertragungsrisiko: HIV kann in dieser Phase weiterhin übertragen werden, obwohl das Risiko geringer ist als in der akuten Phase. Wenn die ART wirksam ist und die Viruslast nicht nachweisbar ist, ist das Übertragungsrisiko null (Konzept „nicht nachweisbar = nicht übertragbar“).
Bedeutung der Behandlung: ART ist entscheidend, um das Virus zu unterdrücken, die Funktion des Immunsystems zu erhalten und den Übergang zu AIDS zu verhindern. Regelmäßige HIV-Tests sind wichtig, da viele Menschen in dieser Phase ihren Status nicht kennen.
AIDS (Erworbenes Immundefizienzsyndrom)
Beschreibung: Dies ist die schwerste Phase der HIV-Infektion, in der das Immunsystem ernsthaft geschädigt ist und nicht mehr effektiv gegen Infektionen kämpfen kann. Die Diagnose AIDS wird gestellt, wenn die CD4-Zellzahl unter 200 Zellen pro Kubikmillimeter Blut fällt (normaler Bereich: 500–1500 Zellen/mm³) oder bestimmte opportunistische Infektionen wie Pneumocystis-Pneumonie (PCP) oder Tuberkulose auftreten.
Symptome: In dieser Phase können Symptome wie Gewichtsverlust, chronischer Durchfall, Nachtschweiß, Fieber, Müdigkeit und wiederkehrende Infektionen auftreten. Opportunistische Infektionen und Krebserkrankungen wie das Kaposi-Sarkom werden häufig.
Dauer: Ohne Behandlung beträgt die Überlebensdauer nach der AIDS-Diagnose etwa 3 Jahre. Mit ART können Menschen mit AIDS jedoch viel länger leben und eine bessere Lebensqualität erhalten.
Übertragungsrisiko: Die Viruslast ist in dieser Phase oft hoch, was die Übertragung von HIV erleichtert.
Bedeutung der Behandlung: Selbst in der AIDS-Phase kann ART effektiv sein, um die Funktion des Immunsystems zu verbessern, die Viruslast zu senken und das Risiko opportunistischer Infektionen zu verringern.
Diagnose von HIV
Studien zeigen, dass die HIV-Diagnose Tests auf Antikörper, Antigene und Nukleinsäuren umfasst.
Antikörpertests und Antigen-/Antikörpertests werden üblicherweise für das erste Screening verwendet, während Nukleinsäuretests für die Früherkennung eingesetzt werden.
Die Bestätigung der Diagnose erfordert zusätzliche Tests wie Western Blot oder PCR.
Das Reaktionsfenster variiert: von 10 Tagen bei Nukleinsäuretests bis zu 3 Monaten bei Antikörpertests.
Die Diagnose einer HIV-Infektion ist ein Prozess, der hilft, das Vorhandensein des Virus im Körper festzustellen, indem entweder der Virus selbst oder die vom Körper als Reaktion auf die Infektion produzierten Antikörper nachgewiesen werden. Dieser Prozess beginnt in der Regel mit Screening-Tests, gefolgt von Bestätigungstests, um falsche Ergebnisse auszuschließen. Es ist wichtig zu verstehen, dass eine frühzeitige Diagnose eine frühzeitige Behandlung ermöglicht und das Risiko der Übertragung des Virus auf andere verringert.
Arten von Tests
Es gibt mehrere Testarten, von denen jede ihre eigenen Besonderheiten hat:
Antikörpertests: Überprüfen Blut oder Speichel auf das Vorhandensein von HIV-Antikörpern. Sie sind der Standard für routinemäßiges Screening, können jedoch eine Infektion kurz nach der Ansteckung nicht erkennen.
Antigen- und Antikörpertests: Erkennen sowohl Antikörper als auch das p24-Antigen, was eine frühere Erkennung von HIV ermöglicht als reine Antikörpertests. Dies ist die häufigste Methode der Erstdiagnose.
Nukleinsäuretests (NAT): Überprüfen das Blut auf virale RNA und können eine Infektion bereits 10–33 Tage nach der Ansteckung diagnostizieren. Sie werden nicht für alle verwendet, sondern bei hohem Risiko oder Symptomen einer akuten Infektion.
Diagnoseprozess
Wenn ein Screening-Test positiv ist, wird ein Bestätigungstest wie Western Blot oder PCR durchgeführt, um die Diagnose zu sichern. Dies ist wichtig, da falsch positive Ergebnisse möglich, aber selten sind. Wenn der Test negativ ist, aber ein Infektionsrisiko besteht, wird empfohlen, den Test nach einigen Wochen zu wiederholen, unter Berücksichtigung des Reaktionsfensters.
Detaillierte Beschreibung der HIV-Diagnose
Die Diagnose einer HIV-Infektion ist ein komplexer Prozess, der verschiedene Methoden umfasst, die das Virus in verschiedenen Stadien der Infektion nachweisen können. Im Folgenden wird eine detaillierte Beschreibung der Methoden gegeben, basierend auf Informationen aus zuverlässigen Quellen wie den Zentren für Krankheitskontrolle und Prävention (CDC), den Nationalen Gesundheitsinstituten (NIH) und anderen medizinischen Ressourcen. Diese Informationen umfassen die Testarten, ihre Sensitivität, das Reaktionsfenster und Anwendungsempfehlungen und bieten einen umfassenden Überblick zur besseren Verständnis des Diagnoseprozesses.
Allgemeine Informationen zur HIV-Diagnose
HIV (Humanes Immundefizienz-Virus) kann diagnostiziert werden, indem entweder der Virus selbst oder die vom Körper als Reaktion auf die Infektion produzierten Antikörper nachgewiesen werden. Die Diagnose beginnt üblicherweise mit Screening-Tests, die empfindlich sind, aber falsch positive Ergebnisse liefern können. Daher erfordern positive Ergebnisse eine Bestätigung durch spezifischere Tests. Die Früherkennung von HIV ist entscheidend, da sie eine frühzeitige antiretrovirale Therapie (ART) ermöglicht, das Fortschreiten der Infektion verlangsamt und das Risiko der Übertragung des Virus auf andere reduziert. Laut CDC werden etwa 40 % der neuen HIV-Infektionen von Menschen übertragen, die ihren Status nicht kennen, was die Bedeutung regelmäßiger Tests unterstreicht.
Arten von Tests zur HIV-Diagnose
Es gibt drei Hauptkategorien von Tests, die zur Diagnose von HIV verwendet werden, jede mit ihren eigenen Vor- und Nachteilen. Im Folgenden finden Sie eine detaillierte Beschreibung jeder Art, einschließlich des Reaktionsfensters (Zeitraum zwischen Infektion und Nachweisbarkeit der Infektion) und der verwendeten Probenarten.
1. Antikörpertests
Beschreibung: Diese Tests erkennen Antikörper gegen HIV (Immunglobuline M und G, IgM und IgG) im Blut oder Speichel. Antikörper sind Proteine, die das Immunsystem als Reaktion auf eine Infektion produziert.
Reaktionsfenster: Normalerweise 2 bis 12 Wochen nach der Infektion, abhängig vom Testtyp. Tests mit venösem Blut können Antikörper früher nachweisen als Tests mit Fingerblut oder Speichel.
Probenarten: Blut (aus einer Vene oder einem Finger) oder Speichel.
Beispiele: Schnelltests wie Tests mit Fingerblut und Heimtests wie der OraQuick In-Home HIV-Test (FDA-zugelassener Test).
Anwendung: Dies sind Standardtests für routinemäßiges Screening, insbesondere für Menschen mit niedrigem oder mittlerem Risiko. Sie sind in Kliniken, Krankenhäusern und Apotheken verfügbar.
Einschränkungen: Können eine Infektion nicht sofort nach der Ansteckung erkennen, da Antikörper in der Anfangsphase der Infektion (im Reaktionsfenster) fehlen können.
2. Antigen- und Antikörpertests
Beschreibung: Diese Tests, auch als Kombinationstests bekannt, erkennen gleichzeitig Antikörper gegen HIV und das p24-Antigen (ein Protein, das in den frühen Stadien der Infektion im Blut erscheint). Dies sind Tests der vierten Generation, die zum Standard für die Erstdiagnose geworden sind.
Reaktionsfenster: Normalerweise 18 bis 45 Tage nach der Infektion, kürzer als bei reinen Antikörpertests, dank der Erkennung des p24-Antigens, das früher als Antikörper erscheint.
Probenarten: Blut (meist aus einer Vene).
Anwendung: Werden als primärer Screening-Test in den meisten medizinischen Einrichtungen verwendet, da sie eine Infektion in einem früheren Stadium erkennen können.
Einschränkungen: Obwohl sie empfindlicher sind als reine Antikörpertests, können sie eine Infektion in den ersten Wochen nach der Ansteckung dennoch nicht erkennen.
3. Nukleinsäuretests (NAT)
Beschreibung: Diese Tests, auch als Tests auf die Viruslast bekannt, erkennen das genetische Material des Virus (HIV-RNA) im Blut. Sie ermöglichen eine Diagnose der Infektion im frühesten Stadium, noch bevor Antikörper oder das p24-Antigen erscheinen.
Reaktionsfenster: 10 bis 33 Tage nach der Infektion, was sie zu den frühesten Diagnosetests macht.
Probenarten: Blut aus einer Vene.
Anwendung: Werden nicht für routinemäßiges Screening verwendet, sondern in folgenden Fällen:
• Verdacht auf akute Infektion (z. B. nach hohem Infektionsrisiko).
• Symptome, die mit einer akuten HIV-Infektion übereinstimmen (z. B. Fieber, Ausschlag, vergrößerte Lymphknoten).
• Zur Überwachung der Behandlung bei bereits diagnostizierten Patienten.
Einschränkungen: Teurer und komplexer in der Durchführung, daher nicht für Massenscreenings geeignet.
Algorithmus der HIV-Diagnose
Die HIV-Diagnose folgt normalerweise einem standardisierten Algorithmus, um das Risiko falscher Ergebnisse zu minimieren und die Genauigkeit zu gewährleisten:
Screening-Test:
Ein Test auf Antikörper oder Antigen/Antikörper wird durchgeführt (meist ein Kombinationstest der vierten Generation).
Wenn das Ergebnis negativ ist und kein Verdacht auf eine kürzliche Infektion besteht, kann das Testen abgeschlossen werden.
Wenn das Ergebnis positiv ist, folgt der nächste Schritt.
Bestätigungstest:
Wenn der Screening-Test positiv ist, wird ein spezifischerer Test zur Bestätigung durchgeführt, z. B.:
• Western Blot: Erkennt spezifische HIV-Antikörper.
• Immunfluoreszenz-Assay (IFA): Wird zur Antikörpererkennung verwendet.
• Tests zur Differenzierung von HIV-1- und HIV-2-Antikörpern: Helfen, den Virustyp zu bestimmen.
• Nukleinsäuretests (NAT): Können zur Bestätigung verwendet werden, insbesondere bei frühen Infektionen.
Wenn der Bestätigungstest positiv ist, gilt die HIV-Diagnose als bestätigt.
Zusätzliche Untersuchungen:
Nach der Diagnosebestätigung wird der Zustand des Immunsystems bewertet, einschließlich der Bestimmung des CD4-Zellspiegels und der Viruslast, um die Behandlung zu planen.
Reaktionsfenster und erneutes Testen
Reaktionsfenster: Dies ist der Zeitraum zwischen der HIV-Infektion und dem Zeitpunkt, an dem ein Test die Infektion nachweisen kann. Die Dauer des Fensters hängt vom Testtyp ab:
• NAT: 10–33 Tage.
• Antigen- und Antikörpertests: 18–45 Tage.
• Antikörpertests: bis zu 12 Wochen.
Wenn ein Test zu früh (im Reaktionsfenster) durchgeführt wird, kann das Ergebnis negativ sein, selbst wenn die Person infiziert ist. In solchen Fällen wird empfohlen, den Test nach einigen Wochen zu wiederholen, insbesondere bei Infektionsrisiko.
Zum Beispiel empfiehlt die CDC eine erneute Untersuchung nach 3 Monaten, wenn der Verdacht auf eine kürzliche Infektion besteht (CDC: Testempfehlungen).
Orte für Tests und Verfügbarkeit
HIV-Tests können an verschiedenen Orten durchgeführt werden, darunter:
• Medizinische Kliniken und Krankenhäuser.
• Familienplanungszentren wie Planned Parenthood.
• Apotheken und kommunale Gesundheitszentren.
Es gibt auch Heimtests wie den OraQuick In-Home HIV-Test (FDA-zugelassener Test), der mit Speichel durchgeführt wird und in 20 Minuten ein Ergebnis liefert. Zur Suche nach Teststellen kann der CDC GetTested Locator (GetTested) verwendet werden.
Akutes HIV:
Bei Verdacht auf eine akute Infektion (z. B. nach riskantem Sexualkontakt oder der Verwendung gemeinsamer Nadeln) wird die Verwendung von NAT empfohlen, da Antikörper möglicherweise noch nicht vorhanden sind. Symptome einer akuten Infektion können Fieber, Ausschlag und vergrößerte Lymphknoten umfassen.
Schwangere Frauen:
Allen schwangeren Frauen wird empfohlen, sich auf HIV testen zu lassen, um eine Übertragung der Infektion auf das Kind während der Schwangerschaft, Geburt oder Stillzeit zu verhindern.
Kinder:
Für Kinder von HIV-positiven Müttern werden spezielle Tests verwendet, da mütterliche Antikörper bis zu 18 Monate im Blut des Kindes verbleiben können. Üblicherweise werden NAT eingesetzt, um eine Infektion auszuschließen.
Menschen mit hohem Risiko:
Menschen mit hohem Risiko (z. B. Männer, die Sex mit Männern haben, Menschen, die injizierbare Drogen verwenden, oder Personen mit einem HIV-positiven Partner) sollten häufiger getestet werden, z. B. alle 3–6 Monate, gemäß den CDC-Empfehlungen (CDC: Testempfehlungen).
Tabelle: Vergleich der HIV-Diagnosemethoden
Testart Erkennt Reaktionsfenster Probenart Anwendung Einschränkungen
Antikörpertests Antikörper (IgM, IgG) 2–12 Wochen Blut, Speichel Routinescreening, Schnell- und Heimtests Langes Fenster, erkennt keine frühe Infektion
Antigen-/Antikörpertests Antikörper und p24-Antigen 18–45 Tage Blut Standard für Erstdiagnose Kann Infektion in ersten Wochen nicht erkennen
Nukleinsäuretests (NAT) HIV-RNA 10–33 Tage Venöses Blut Früherkennung, Therapieüberwachung Teuer, nicht für Routinescreening.
Behandlungskonzept der HIV-Infektion:
Die Behandlung der HIV-Infektion hat in den letzten Jahrzehnten enorme Fortschritte gemacht. Dank moderner antiretroviraler Therapie (ART) können Menschen mit HIV heute ein nahezu normales Leben führen, die Viruslast auf ein nicht nachweisbares Niveau senken und die Übertragung des Virus verhindern. Diese Artikel beleuchtet die aktuellen Ansätze, Medikamente, Herausforderungen und Perspektiven der HIV-Therapie.
Was ist die antiretroviral Therapie (ART)?
Die antiretroviral Therapie (ART) ist die Standardbehandlung für HIV. Sie besteht aus einer Kombination von Medikamenten, die die Vermehrung des Virus im Körper unterdrücken. Ziel der ART ist es:
• Die Viruslast (Menge des Virus im Blut) auf ein nicht nachweisbares Niveau zu reduzieren.
• Die Schädigung des Immunsystems zu verlangsamen oder zu stoppen, indem die CD4-Zellen geschützt werden.
• Das Risiko von opportunistischen Infektionen und dem Übergang zu AIDS zu minimieren.
• Die Übertragung des Virus auf andere Personen zu verhindern („nicht nachweisbar = nicht übertragbar“).
ART ist keine Heilung, da HIV im Körper in sogenannten „Reservoirs“ (z. B. ruhenden Immunzellen) verbleiben kann. Sie ermöglicht jedoch eine chronische Kontrolle der Infektion.
Wie funktioniert die ART?
HIV greift das Immunsystem an, indem es sich in CD4-Zellen (eine Art weißer Blutkörperchen) integriert und vermehrt. ART-Medikamente wirken an verschiedenen Punkten des viralen Lebenszyklus:
1. Eintrittsinhibitoren: Verhindern, dass HIV in die CD4-Zellen eindringt.
2. Nukleosid-/Nukleotid-Reverse-Transkriptase-Inhibitoren (NRTIs): Blockieren das Enzym Reverse Transkriptase, das HIV benötigt, um sein genetisches Material zu vervielfältigen.
3. Nicht-Nukleosid-Reverse-Transkriptase-Inhibitoren (NNRTIs): Hemmen ebenfalls die Reverse Transkriptase, jedoch auf andere Weise.
4. Integrase-Inhibitoren: Verhindern, dass das Virus sein genetisches Material in die DNA der Wirtszelle integriert.
5. Protease-Inhibitoren: Blockieren das Enzym Protease, das für die Reifung neuer Viruspartikel notwendig ist.
Eine typische ART besteht aus einer Kombination von mindestens drei Medikamenten aus verschiedenen Klassen, um die Wirksamkeit zu maximieren und Resistenzen zu verhindern.
Aktuelle Medikamente und Behandlungsregime
Die modernen ART-Regime sind einfacher und verträglicher als früher. Viele Patienten nehmen heute nur noch eine Tablette pro Tag, die mehrere Wirkstoffe kombiniert („Single-Tablet-Regime“). Beispiele für häufig verwendete Medikamente sind:
• Biktarvy (Bictegravir, Emtricitabin, Tenofoviralafenamid): Ein weit verbreitetes Single-Tablet-Regime.
• Dovato (Dolutegravir, Lamivudin): Eine Zwei-Drug-Kombination für bestimmte Patienten.
• Triumeq (Dolutegravir, Abacavir, Lamivudin): Eine weitere beliebte Option.
Zusätzlich gibt es langwirksame injizierbare Therapien wie Cabenuva (Cabotegravir und Rilpivirin), die alle 1–2 Monate verabreicht werden und für Patienten geeignet sind, die Schwierigkeiten mit der täglichen Einnahme haben.
Phasen der Behandlung
1. Diagnose und Therapiebeginn: Nach der Diagnose wird die Viruslast und der CD4-Wert gemessen. Die WHO und die meisten Gesundheitsbehörden empfehlen, die ART unabhängig vom CD4-Wert sofort zu beginnen („Test-and-Treat“-Strategie).
2. Initiale Phase: In den ersten Wochen bis Monaten wird die Viruslast überwacht, um sicherzustellen, dass sie sinkt. Nebenwirkungen wie Übelkeit oder Müdigkeit können auftreten, sind aber meist vorübergehend.
3. Langzeitmanagement: Ziel ist eine dauerhaft nicht nachweisbare Viruslast (unter 50 Kopien/ml). Regelmäßige Arztbesuche (alle 3–6 Monate) und Bluttests sind notwendig.
Vorteile der modernen ART
• Lebenserwartung: Bei frühzeitigem Therapiebeginn können HIV-positive Menschen eine nahezu normale Lebenserwartung erreichen.
• Lebensqualität: Weniger Nebenwirkungen und einfachere Regimes verbessern die Compliance.
• Prävention: Eine nicht nachweisbare Viruslast eliminiert das Übertragungsrisiko, was auch als „U=U“ (Undetectable = Untransmittable) bekannt ist.
Herausforderungen und Nebenwirkungen
Trotz der Fortschritte gibt es Herausforderungen:
• Nebenwirkungen: Moderne Medikamente sind gut verträglich, aber einige Patienten erleben Müdigkeit, Magen-Darm-Beschwerden oder langfristige Effekte wie Lipidveränderungen.
• Resistenz: Bei unregelmäßiger Einnahme kann das Virus resistent werden, was einen Wechsel des Regimes erfordert.
• Kosten: In Ländern ohne universelle Gesundheitsversorgung können die Kosten eine Barriere darstellen, obwohl generische Medikamente die Zugänglichkeit verbessern.
• Stigma: Soziales Stigma kann die Bereitschaft zur Behandlung beeinträchtigen.
Prävention und ergänzende Ansätze
Neben der ART spielen präventive Maßnahmen eine wichtige Rolle:
• PrEP (Präexpositionsprophylaxe): Medikamente wie Truvada oder Descovy werden von HIV-negativen Personen mit hohem Risiko eingenommen, um eine Infektion zu verhindern.
• PEP (Postexpositionsprophylaxe): Eine Notfallbehandlung innerhalb von 72 Stunden nach möglichem Kontakt mit HIV.
• Impfstoffforschung: Obwohl es noch keinen zugelassenen HIV-Impfstoff gibt, laufen vielversprechende Studien.
Zukunftsperspektiven
Die Forschung arbeitet an:
• Heilung: Strategien zur Eliminierung der viralen Reservoirs, z. B. durch „Shock-and-Kill“-Ansätze oder Gentherapie.
• Langwirksame Therapien: Injektionen oder Implantate, die über Monate oder Jahre wirken.
• Verbesserte Zugänglichkeit: Kostengünstige Medikamente für Länder mit niedrigem Einkommen.
Fazit
Die moderne Behandlung der HIV-Infektion hat die Krankheit von einem Todesurteil zu einer beherrschbaren chronischen Erkrankung transformiert. Frühzeitige Diagnose, konsequente ART und regelmäßige Überwachung sind der Schlüssel zu einem langen, gesunden Leben mit HIV. Gleichzeitig bleibt die globale Herausforderung bestehen, den Zugang zu diesen lebensrettenden Therapien für alle Betroffenen zu gewährleisten.
Prävention: Wie man sich und andere schützt
Die HIV-Prävention umfasst individuelle und gesellschaftliche Maßnahmen:
• Sicherer Sex. Kondome reduzieren das Infektionsrisiko um 90–95 %.
• PrEP (Präexpositionsprophylaxe). Die tägliche Einnahme von Medikamenten (z. B. Truvada) durch Risikogruppen senkt die Ansteckungsgefahr nahezu auf null.
• PEP (Postexpositionsprophylaxe). Ein Notfallkurs innerhalb von 72 Stunden nach möglichem Kontakt (z. B. Vergewaltigung oder Nadelstich).
• Sterile Instrumente. Verzicht auf gemeinsame Spritzen und Kontrolle der Sterilität in medizinischen Einrichtungen.
• Aufklärung. Informationen über Übertragungswege und Mythen über HIV verringern Stigmatisierung und fördern Tests.
HIV weltweit: Statistiken, Herausforderungen und Perspektiven
HIV (Humanes Immundefizienz-Virus) bleibt eines der bedeutendsten globalen Gesundheitsprobleme. Seit Beginn der Epidemie in den 1980er Jahren hat der Virus Millionen von Leben gefordert, doch dank wissenschaftlicher Fortschritte wie der antiretroviralen Therapie (ART) hat sich die Situation erheblich verbessert. Dieser Artikel bietet einen Überblick über aktuelle Statistiken zu HIV weltweit, die zentralen Herausforderungen und mögliche Lösungsansätze.
Globale HIV-Statistiken
Laut Daten des Gemeinsamen Programms der Vereinten Nationen zu HIV/AIDS (UNAIDS) für 2023:
• Menschen mit HIV: Weltweit leben etwa 39,9 Millionen Menschen [Bereich: 36,1–44,6 Millionen] mit HIV. Das entspricht etwa der Bevölkerung von Ländern wie Polen oder Kanada.
• Neue Infektionen: Im Jahr 2023 wurden 1,3 Millionen neue Infektionen [1–1,7 Millionen] registriert – weniger als in den Höchstzeiten der vergangenen Jahrzehnte, aber noch weit entfernt vom Ziel der vollständigen Eindämmung.
• AIDS-bedingte Todesfälle: Rund 630.000 Menschen [500.000–820.000] starben 2023 an AIDS-bedingten Krankheiten.
• Zugang zur Behandlung: 30,7 Millionen Menschen [27–31,9 Millionen] erhielten 2023 ART, ein deutlicher Anstieg im Vergleich zu 7,7 Millionen im Jahr 2010. Das Ziel, bis 2025 34 Millionen Menschen zu erreichen, wurde jedoch noch nicht erreicht.
• Historische Daten: Seit Beginn der Epidemie haben sich 88,4 Millionen Menschen [71,3–112,8 Millionen] mit HIV infiziert, davon starben 42,3 Millionen [35,7–51,1 Millionen] an AIDS-bedingten Ursachen.
Regionale Verteilung:
• Afrika südlich der Sahara: Diese Region ist am stärksten betroffen – hier leben etwa 25,6 Millionen Menschen mit HIV (Stand 2015, aktuelle Zahlen sind etwas höher). 2023 entfielen 3100 der wöchentlich 4000 neuen Fälle unter jugendlichen Mädchen und jungen Frauen (15–24 Jahre) auf diese Region.
• Osteuropa und Zentralasien: Hier steigt die Zahl neuer Infektionen, insbesondere in Russland, wo 2021 etwa 58.500 neue Fälle registriert wurden (3,9 % der weltweiten Neuinfektionen).
• Westeuropa und Nordamerika: Die Zahl neuer Infektionen bleibt stabil oder sinkt dank breitem Zugang zu Tests und Behandlung.
Ziele 95-95-95: UNAIDS hat das Ziel gesetzt, bis 2025 zu erreichen, dass 95 % der Menschen mit HIV ihren Status kennen, 95 % von ihnen eine Behandlung erhalten und 95 % der Behandelten eine supprimierte Viruslast haben. 2023 lagen die Werte bei: 86 % kannten ihren Status, 77 % erhielten eine Behandlung, 72 % erreichten eine Viruslastsuppression.
Hauptherausforderungen
Trotz der Fortschritte steht die Bekämpfung von HIV vor erheblichen Hindernissen:
1. Ungleichmäßiger Zugang zu Behandlung und Prävention:
o In Ländern mit niedrigem und mittlerem Einkommen wissen etwa 5,4 Millionen Menschen nicht von ihrem Status, und Millionen haben aufgrund finanzieller oder logistischer Barrieren keinen Zugang zu ART.
o In Afrika südlich der Sahara bleibt der Zugang zur Behandlung, insbesondere in ländlichen Gebieten, eingeschränkt.
2. Stigma und Diskriminierung:
o Soziale Stigmatisierung hindert Menschen daran, sich testen zu lassen oder eine Behandlung zu suchen. In Russland beispielsweise meinen 14 % der Befragten, Menschen mit HIV sollten isoliert werden, und 2 % befürworten ihre Beseitigung (Daten des Lewada-Zentrums).
o Marginalisierte Gruppen (z. B. Männer, die Sex mit Männern haben, oder intravenös Drogenkonsumierende) sind stärkerer Diskriminierung ausgesetzt, was ihre Verwundbarkeit erhöht.
3. Neue Fälle unter vulnerablen Gruppen:
o Jugendliche (15–24 Jahre) machen etwa 40 % der neuen Fälle unter Erwachsenen aus. In Ost- und Südafrika liegt die Prävalenz bei Mädchen im Alter von 15–24 Jahren bei 2,3 %.
o Unter schwulen Männern und anderen Männern, die Sex mit Männern haben, beträgt die mediane Prävalenz 7,7 %.
4. Medikamentenresistenz:
o Unregelmäßige Einnahme von ART führt zur Resistenz des Virus, was die Behandlung erschwert und teurere Medikamente erfordert.
5. Finanzierung:
o 2023 wurden 19,8 Milliarden US-Dollar für die AIDS-Bekämpfung in Ländern mit niedrigem und mittlerem Einkommen bereitgestellt, davon 59 % aus nationalen Quellen. Dies reicht jedoch nicht aus, um die Ziele für 2030 (Beendigung der Epidemie) zu erreichen.
6. Regionale Besonderheiten:
o In Russland hat die Epidemie eine verallgemeinerte Stufe erreicht (mehr als 1 % der Bevölkerung sind in einigen Regionen wie der Oblast Kemerowo mit 1,5 % infiziert). Der Hauptübertragungsweg ist heterosexueller Kontakt (77,6 %).
o Kriege und Krisen (z. B. in der Ukraine) stören die Medikamentenversorgung und erhöhen die Zahl unerkannter Fälle.
Perspektiven und Lösungsansätze
1. Erweiterung des Zugangs zu ART:
o Eine Ausweitung von Tests und Behandlung, insbesondere in Afrika und Osteuropa, könnte die Zahl neuer Fälle und Todesfälle erheblich senken.
o Generika und sinkende Medikamentenpreise verbessern die Zugänglichkeit.
2. Prävention:
o PrEP und PEP: Präexpositionsprophylaxe (PrEP) und Postexpositionsprophylaxe (PEP) haben sich als wirksam erwiesen. PrEP reduziert das Infektionsrisiko bei korrekter Anwendung um 99 %.
o Ausweitung von Programmen zur Verteilung von Kondomen und Spritzen für Risikogruppen.
3. Bekämpfung von Stigma:
o Aufklärungskampagnen zur Veränderung der Einstellung gegenüber Menschen mit HIV könnten die Bereitschaft zu Tests und Behandlung erhöhen.
4. Forschung:
o Impfstoffentwicklung: Obwohl es noch keinen zugelassenen Impfstoff gibt, bieten klinische Studien (z. B. Mosaico und Imbokodo) Hoffnung.
o Beseitigung von Reservoirs: Ansätze wie „Shock-and-Kill“ oder Gentherapie könnten zu einer vollständigen Heilung führen.
5. Internationale Zusammenarbeit:
o Erhöhte Finanzierung durch wohlhabende Länder und Organisationen wie den Globalen Fonds könnte Lücken in der Behandlung schließen.
Medizinisches Cannabis bei HIV – Einsatz, Wirkung und rechtlicher Rahmen
Die Human Immunodeficiency Virus (HIV)-Infektion ist eine chronische Erkrankung, die auch unter antiretroviraler Therapie (ART) mit einer Vielzahl von Symptomen und Nebenwirkungen einhergehen kann. Neben der konventionellen medikamentösen Therapie gibt es ergänzende Maßnahmen, die helfen sollen, Lebensqualität und Symptomkontrolle zu verbessern – dazu zählt in einigen Fällen auch der Einsatz von medizinischem Cannabis.
1. Hintergrund und Symptomatik bei HIV
Trotz erfolgreicher Virusunterdrückung durch ART leiden viele HIV-positive Menschen an Begleitsymptomen, die entweder direkt durch das Virus oder durch die Nebenwirkungen der Therapie verursacht werden. Dazu gehören u.a.:
Appetitlosigkeit und Gewichtsverlust (HIV-Wasting-Syndrom)
Übelkeit und Erbrechen
Chronische Schmerzen (insbesondere neuropathischer Art)
Schlafstörungen
Angstzustände und depressive Verstimmungen
Diese Symptome können den Alltag erheblich beeinträchtigen und sind nicht immer mit herkömmlichen Medikamenten ausreichend therapierbar.
2. Einsatzgebiete von medizinischem Cannabis bei HIV
a) Appetitstimulation und Gewichtserhalt
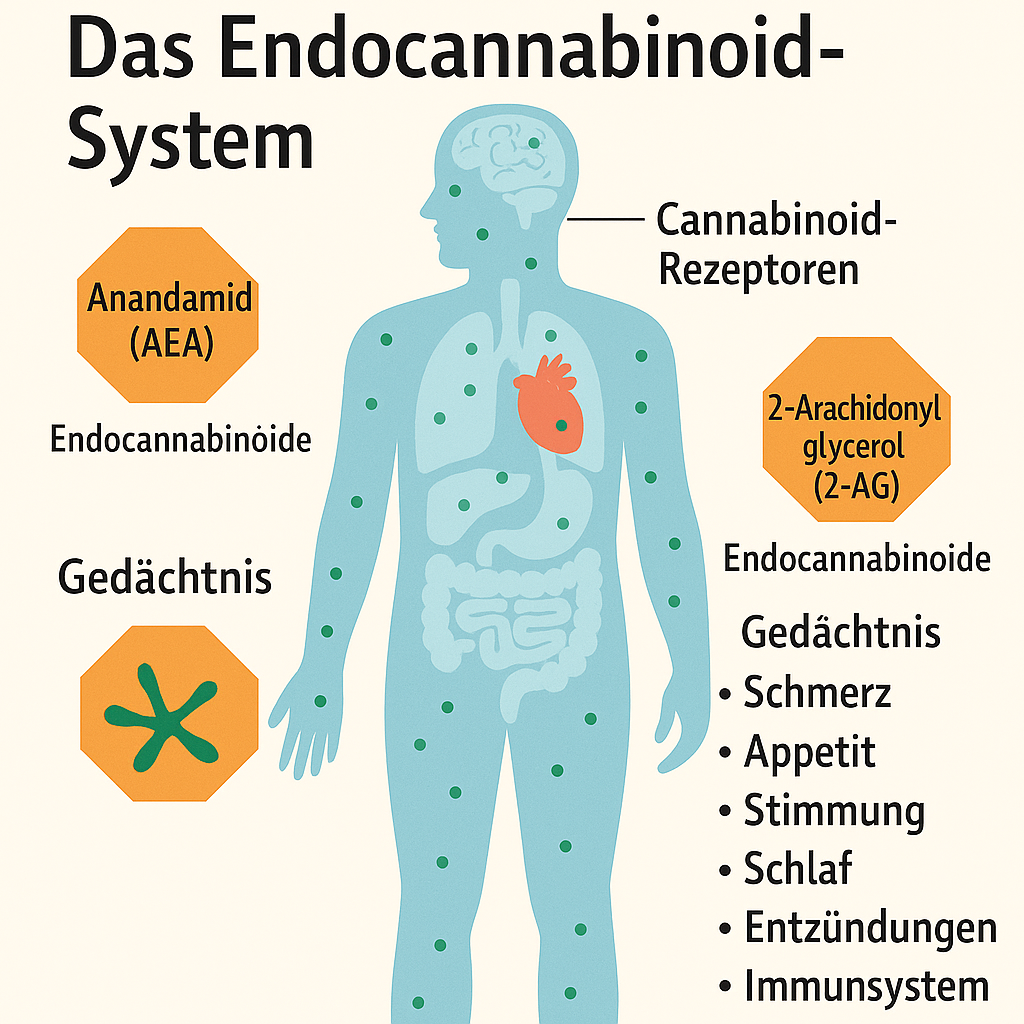
Bereits in den 1990er-Jahren wurde Cannabis – insbesondere der Wirkstoff THC (Tetrahydrocannabinol) – zur Behandlung des sog. HIV-Wasting-Syndroms eingesetzt. THC wirkt über Cannabinoidrezeptoren (v.a. CB1) appetitanregend und kann bei Gewichtsverlust helfen, insbesondere wenn dieser durch mangelnden Appetit oder Übelkeit verursacht ist.
b) Linderung von Übelkeit und Erbrechen
Übelkeit ist eine häufige Nebenwirkung antiretroviraler Medikamente. Cannabinoide wirken im zentralen Nervensystem auf die Brechzentren und können so antiemetisch (gegen Übelkeit) wirken – ähnlich wie bei onkologischen Patient:innen unter Chemotherapie.
c) Behandlung von neuropathischen Schmerzen
Periphere Neuropathien treten bei HIV selbst sowie als Nebenwirkung bestimmter antiretroviraler Substanzen (z. B. Stavudin) auf. Diese Schmerzen sprechen oft schlecht auf klassische Analgetika an. Studien belegen, dass inhalatives Cannabis bei neuropathischen Schmerzen wirksam sein kann – insbesondere durch die Kombination aus THC und dem weniger psychoaktiven CBD (Cannabidiol).
d) Psychische Begleitsymptome
Viele Betroffene leiden unter Schlafstörungen, Ängsten oder depressiven Episoden. Während Cannabis hier nicht als Erstlinientherapie gilt, berichten einige Patient:innen über eine subjektive Verbesserung. Vorsicht ist jedoch bei vorbestehenden psychischen Erkrankungen geboten, da THC in höheren Dosen auch psychotrope Effekte haben kann.
3. Studienlage
Mehrere klinische Studien – u.a. aus den USA – zeigen positive Effekte von Cannabis bei HIV:
Abrams et al. (2007, Neurology): THC-reiches Cannabis reduzierte neuropathische Schmerzen signifikant im Vergleich zu Placebo.
Haney et al. (2005): Cannabis führte zu gesteigertem Appetit und Gewichtszunahme.
Zuardi et al.: Hinweise auf anxiolytische (angstlösende) Wirkung durch CBD.
Autorin: Dr.med Olena Orlova