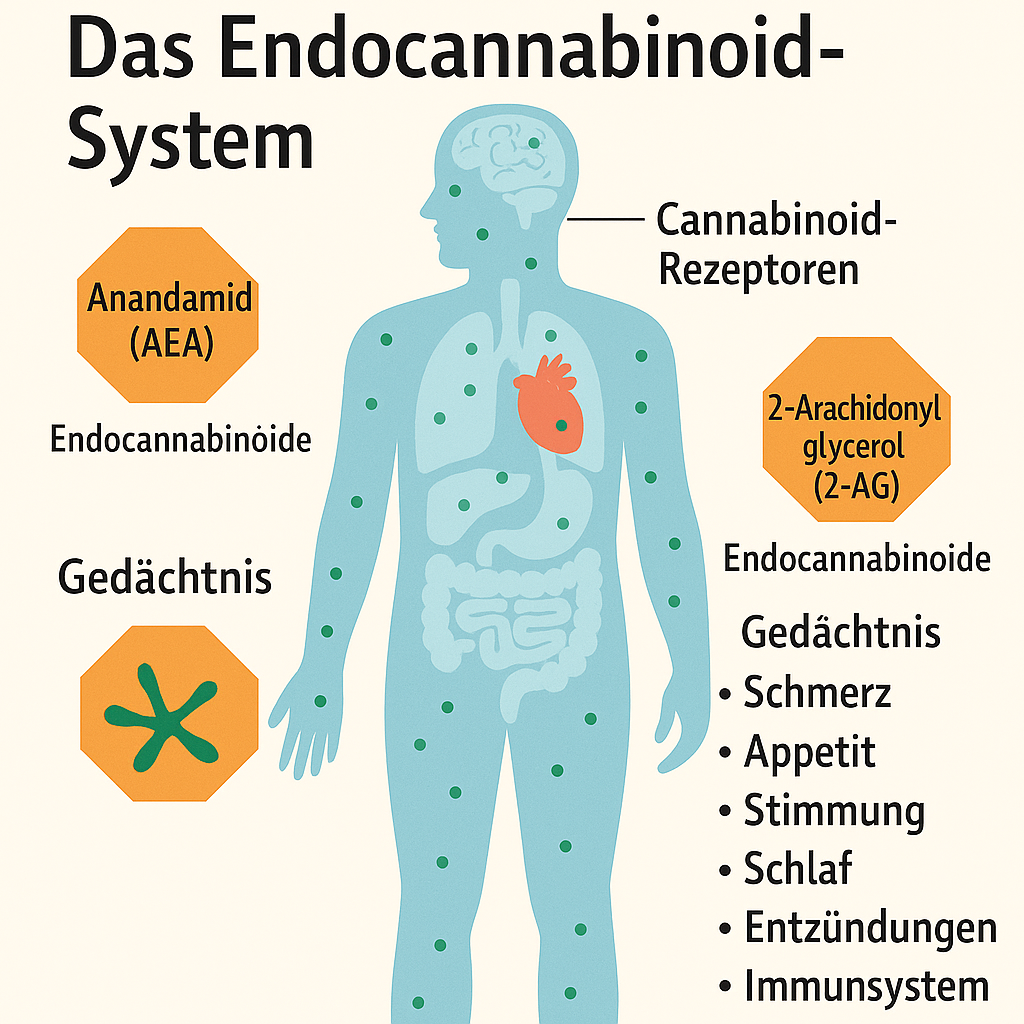
Das Endocannabinoid-System (ECS) als therapeutisches Ziel
Klinische Bedeutung: Das Endocannabinoid-System (ECS) als therapeutisches Ziel
Das Endocannabinoid-System (ECS) ist ein komplexes Netzwerk von Signalwegen, das Endocannabinoide (2-AG, Anandamid), Rezeptoren (CB1, CB2 und andere) sowie Synthese- (DAGL, NAPE-PLD) und Abbauenzyme (MAGL, FAAH) umfasst. Aufgrund seiner Vielseitigkeit und ubiquitären Präsenz im Körper ist das ECS ein vielversprechendes Ziel für die Behandlung zahlreicher Erkrankungen. Im Folgenden wird die klinische Bedeutung des ECS detailliert untersucht, mit Schwerpunkt auf Mechanismen, spezifischen Krankheiten, therapeutischen Ansätzen und aktuellen Herausforderungen.
1. Neurologische Erkrankungen
Das ECS reguliert das Gleichgewicht zwischen Erregung und Hemmung im Nervensystem und ist daher ein zentrales Ziel für neurologische Erkrankungen.
Epilepsie
Mechanismus: Durch die Aktivierung von CB1-Rezeptoren an präsynaptischen Terminals unterdrückt das ECS die übermäßige Freisetzung von Glutamat (DSE) und verhindert so eine Übererregbarkeit. CB2-Rezeptoren reduzieren neuroinflammatorische Prozesse, die Anfälle verstärken können.
Klinische Daten: CBD (Cannabidiol, Epidiolex) ist für die Behandlung resistenter Epilepsieformen wie Dravet- und Lennox-Gastaut-Syndrom zugelassen. Klinische Studien (Devinsky et al., 2017) zeigten eine Reduktion der Anfallshäufigkeit um 39–50 % bei Patienten mit therapierefraktärer Epilepsie. THC zeigt ebenfalls antikonvulsive Wirkungen in Tiermodellen, jedoch schränkt seine Psychoaktivität die Anwendung ein.
Perspektiven: FAAH-Hemmer (zur Erhöhung von Anandamid) werden als Alternative mit weniger Nebenwirkungen getestet.
Neurodegenerative Erkrankungen
Alzheimer-Krankheit: Die Anhäufung von Beta-Amyloid ist mit einer Dysregulation des ECS verbunden. Die Aktivierung von CB1 schützt Neuronen vor oxidativem Stress, während CB2 die Aktivierung von Mikroglia reduziert (Aso & Ferrer, 2014).
O Parkinson-Krankheit: Ein Rückgang der CB1-Spiegel in den Basalganglien korreliert mit motorischen Störungen. THC und CBD könnten Tremor und Rigidität lindern, obwohl die klinischen Daten begrenzt sind.
Klinische Studien: Präparate wie Sativex (THC+CBD) werden für die symptomatische Therapie getestet, ihre Wirksamkeit bedarf jedoch weiterer Bestätigung.
Multiple Sklerose
Mechanismus: Die Aktivierung von CB1 reduziert Spastik durch Modulation glutamaterger und GABAerger Signalwege, während CB2 Entzündungen im ZNS unterdrückt.
Anwendung: Sativex ist in mehreren Ländern zur Behandlung von Spastik zugelassen. Die Studie von Zajicek et al. (2012) zeigte eine signifikante Verbesserung bei 60 % der Patienten.
Herausforderungen: Dosisabhängige Nebenwirkungen (Schwindel, Müdigkeit) erfordern eine Optimierung der Therapie.
2. Chronische Schmerzen
Das ECS reguliert die Schmerzsignale über zentrale (CB1) und periphere (CB2) Mechanismen.
Neuropathische Schmerzen
Mechanismus: CB1-Rezeptoren im Rückenmark und peripheren Nerven reduzieren Hyperalgesie, indem sie die Freisetzung erregender Neurotransmitter hemmen. CB2 mindert Entzündungen in geschädigten Geweben.
Klinische Anwendung: Dronabinol (synthetisches THC) und Nabilon werden zur Behandlung neuropathischer Schmerzen bei Krebs und HIV eingesetzt. Die Studie von Svendsen et al. (2004) zeigte eine Schmerzreduktion um 30 % bei THC-Anwendung bei Multipler Sklerose.
Perspektiven: CBD und MAGL-Hemmer werden als weniger psychoaktive Alternativen untersucht.
Entzündliche Schmerzen
Mechanismus: CB2-Rezeptoren in Makrophagen und Neutrophilen unterdrücken die Freisetzung von Zytokinen (TNF-α, IL-6). CBD verstärkt diesen Effekt durch Erhöhung von 2-AG und Anandamid.
Beispiele: CBD zeigte Wirksamkeit in Tiermodellen von Arthritis (Hammell et al., 2016), indem es Entzündungen und Schmerzen ohne psychoaktive Effekte reduzierte.
Synergie: Die Kombination von THC und CBD (1:1) in Sativex verstärkt die Analgesie durch den Entourage-Effekt.
3. Psychische Störungen
Das ECS moduliert emotionale und Stressreaktionen über das limbische System.
Angststörungen und PTSD
Mechanismus: CBD hemmt FAAH, erhöht Anandamid und aktiviert CB1 in der Amygdala, was die Angst reduziert. Es interagiert auch mit 5-HT1A-Rezeptoren.
Klinische Daten: Bergamaschi et al. (2011) zeigten eine Angstverminderung bei Patienten mit Sozialphobie nach 600 mg CBD. Bei PTSD erleichtert CBD die Konsolidierung traumatischer Erinnerungen (Bitencourt et al., 2008).
Perspektiven: FAAH-Hemmer (PF-04457845) befinden sich in Phase-II-Studien.
Depression
Mechanismus: Die Aktivierung von CB1 im präfrontalen Kortex und Hippocampus fördert Neurogenese und serotonerge Übertragung.
Einschränkungen: THC kann dual wirken: niedrige Dosen verbessern die Stimmung, hohe Dosen verstärken Depressionen. CBD zeigt stabilere antidepressive Effekte in Tiermodellen (Zanelati et al., 2010).
Herausforderungen: Langzeitstudien zur Sicherheit sind erforderlich.
Schizophrenie
Mechanismus: Erhöhte Anandamidspiegel in der Gehirnflüssigkeit korrelieren mit psychotischen Symptomen. CB1-Antagonisten (Rimonabant) reduzierten Psychosen in Experimenten, verursachten jedoch Depressionen.
Probleme: Psychoaktive Effekte von THC können Symptome bei anfälligen Personen verschlimmern.
4. Entzündliche und Autoimmunerkrankungen
Das ECS reguliert die Immunantwort über CB2-Rezeptoren.
Rheumatoide Arthritis
Mechanismus: CB2 reduziert die Produktion von IL-1β und knorpelabbauenden Enzymen. CBD wirkt antioxidativ.
Daten: In Tiermodellen reduzierte CBD (5–10 mg/kg) Gelenkentzündungen (Malfait et al., 2000).
Perspektiven: Selektive CB2-Agonisten sind in Entwicklung.
Entzündliche Darmerkrankungen (Morbus Crohn, Colitis ulcerosa)
Mechanismus: CB1 reguliert die Darmmotilität, CB2 unterdrückt Schleimhautentzündungen.
Klinische Anwendung: THC lindert Schmerzen und Durchfall (Naftali et al., 2011). CBD wird für Remission getestet.
Herausforderungen: Dosierung und Verabreichung müssen optimiert werden.
5. Metabolische Störungen
Das ECS beeinflusst Appetit und Energiehaushalt.
Fettleibigkeit
Mechanismus: CB1-Antagonisten (Rimonabant) unterdrücken den Appetit und erhöhen den Energieverbrauch.
Geschichte: Rimonabant wurde 2008 wegen Depressionen und Suizidrisiken zurückgezogen.
Perspektiven: Periphere CB1-Antagonisten werden entwickelt, um psychische Effekte zu minimieren.
Diabetes Typ 2
Mechanismus: CB2 verbessert die Insulinsensitivität, CBD reduziert Entzündungen in der Bauchspeicheldrüse.
Daten: Tierversuche zeigen eine Glukosesenkung durch CBD (Weiss et al., 2008).
6. Onkologie
Das ECS beeinflusst Tumorwachstum und Symptome.
Antitumor-Effekte
Mechanismus: THC und CBD induzieren Apoptose über CB1/CB2 und ROS-Wege.
Beispiele: In Glioblastom-Studien unterdrückte THC (10–100 µM) das Zellwachstum (Velasco et al., 2016).
Einschränkungen: Klinische Studien stehen aus.
Symptome: Dronabinol und Nabilon wirken gegen Übelkeit und Kachexie.
7. Therapeutische Ansätze
Agonisten: THC, synthetische Cannabinoide (HU-210).
Abbauhemmer: URB597 (FAAH), JZL184 (MAGL).
CBD: Vielseitiger Wirkstoff mit geringer Toxizität.
Allosterische Modulatoren: PAM CB1 (GAT211) in Entwicklung.
8. Herausforderungen
Nebenwirkungen: Psychoaktivität, Toleranzbildung.
Regulierung: Einschränkungen bei Cannabis bremsen die Forschung.
Pharmakokinetik: Unterschiede im Stoffwechsel erfordern Personalisierung.
Natürliche Wege zur Stimulation des Endocannabinoid-Systems (ECS)
Autorin: Dr.med Olena Orlova