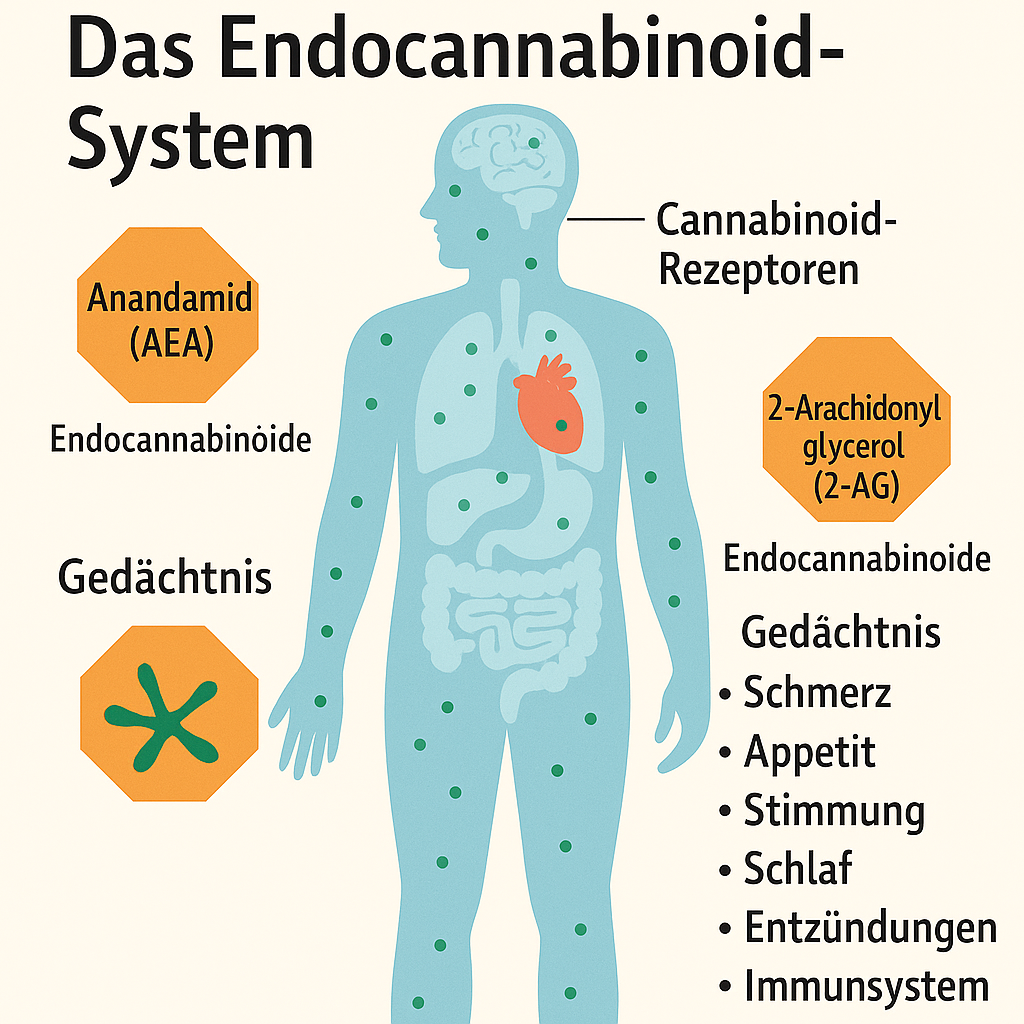
Das Endocannabinoid-System innere Harmonie des Körpers
Das Endocannabinoid-System: innere Harmonie des Körpers
Das Endocannabinoid-System (ECS) ist eines der faszinierendsten und vielseitigsten Systeme des menschlichen Körpers. Es wirkt wie ein unsichtbarer Dirigent, der zahlreiche physiologische Prozesse koordiniert. Seine Entdeckung hat unser Verständnis von Biologie revolutioniert und neue Horizonte in der Medizin, Pharmakologie und sogar Psychologie eröffnet. Das ECS reguliert nicht nur grundlegende Funktionen wie Schmerz, Appetit und Schlaf, sondern spielt auch eine Schlüsselrolle bei komplexeren Prozessen wie emotionaler Stabilität, Lernen und Immunabwehr. In diesem ausführlichen Artikel werden wir die Struktur, Wirkmechanismen, Funktionen, die Verbindung zu Cannabis, die klinische Bedeutung und den Einfluss auf das tägliche Leben detailliert beleuchten.
Die Geschichte der Entdeckung: Vom Cannabis zum inneren System
Die Geschichte der Entdeckung der Verbindung zwischen Cannabis und dem inneren System des Körpers ist eine faszinierende Reise, die mit der Beobachtung einer Pflanze begann und zu grundlegenden Entdeckungen in der menschlichen Biologie führte.
1. Cannabis in der Geschichte
Die Menschheit kennt Cannabis schon lange vor wissenschaftlichen Untersuchungen. Die frühesten Erwähnungen stammen aus dem alten China, etwa 2700 v. Chr. Im Traktat „Pen Ts’ao Ching“, das dem legendären Kaiser Shennong zugeschrieben wird, wird Cannabis („ma“ genannt) als Mittel gegen „Rheumatismus, Gicht, Malaria und Zerstreutheit“ beschrieben. In Indien wurde Cannabis in der ayurvedischen Medizin und in religiösen Ritualen als „Bhang“ oder „Ganja“ verwendet, insbesondere im Kult des Shiva. Im alten Ägypten deuten archäologische Funde, wie Cannabisreste in Gräbern, auf eine Nutzung hin, möglicherweise für Heilzwecke oder Rituale.
Im Mittelalter verbreitete sich Cannabis über den Nahen Osten und Afrika, und in der Kolonialzeit gelangte es nach Europa und Amerika, wo es als Rohstoff für Textilien (Hanf) und als Medizin eingesetzt wurde. Bis ins 19. Jahrhundert blieben seine Wirkungen jedoch empirisch, ohne Verständnis der chemischen Grundlage.
Im Jahr 1839 veröffentlichte der irische Arzt William Brooke O’Shaughnessy, der in Britisch-Indien arbeitete, die Arbeit „On the Preparations of the Indian Hemp, or Gunjah“. Er beschrieb, wie Cannabiextrakte Krämpfe bei Kindern linderten, Schmerzen bei Rheumatismus reduzierten und bei Schlaflosigkeit halfen. Dies war der erste Schritt zur wissenschaftlichen Erforschung der Pflanze in der westlichen Medizin, obwohl der Wirkmechanismus unbekannt blieb.
2. Chemischer Durchbruch: Isolierung von THC und CBD
Die eigentliche wissenschaftliche Geschichte beginnt im 20. Jahrhundert. In den 1940er Jahren isolierte der amerikanische Chemiker Roger Adams an der University of Illinois erstmals Cannabinoide aus der Pflanze, darunter Cannabidiol (CBD), konnte jedoch deren Struktur nicht genau bestimmen. Dies war ein wichtiger Schritt, aber der entscheidende Durchbruch kam später.
Im Jahr 1964 isolierte und charakterisierte der israelische Chemiker Raphael Mechoulam von der Hebräischen Universität in Jerusalem zusammen mit seinen Kollegen Yehiel Gaoni und Habib Edery das Delta-9-Tetrahydrocannabinol (THC) – den Hauptpsychoaktivstoff des Cannabis. Sie extrahierten es aus libanesischem Haschisch mittels Chromatographie und synthetisierten es im Labor. Mechoulam bewies, dass THC Euphorie, Wahrnehmungsveränderungen und Appetitstimulation verursacht – Effekte, die mit dem Konsum von Marihuana verbunden sind.
Gleichzeitig isolierte Mechoulam Cannabidiol (CBD), das keine psychoaktiven Eigenschaften besitzt, aber krampflösende und beruhigende Wirkungen zeigte. Diese Entdeckungen legten den Grundstein für das Verständnis der chemischen Zusammensetzung von Cannabis. Doch die Frage blieb: Wie interagiert THC mit dem Körper? Warum wirkt eine pflanzliche Substanz so präzise auf das menschliche Gehirn?
3. Suche nach Rezeptoren: Von THC zu CB1 und CB2
In den 1980er Jahren wuchs das Interesse an Cannabis durch die Legalisierung seines medizinischen Gebrauchs in einigen Ländern und die Zunahme der Forschung an psychoaktiven Substanzen. Wissenschaftler vermuteten, dass THC mit spezifischen Strukturen im Körper – Rezeptoren – interagieren müsse.
Im Jahr 1988 führte die amerikanische Forscherin Allyn Howlett von der Saint Louis University Experimente mit einem radioaktiv markierten THC-Analogon (CP-55,940, entwickelt von Pfizer) durch. Sie stellte fest, dass diese Substanz sich an bestimmte Stellen im Gehirn von Ratten band, insbesondere in Bereichen, die mit Bewegung, Gedächtnis und Emotionen verbunden sind (Hippocampus, Basalganglien, Kleinhirn). Diese Stellen wurden Cannabinoid-Rezeptoren Typ 1 (CB1) genannt. Dies war der erste Hinweis auf ein System, das auf Cannabinoide reagiert.
Im Jahr 1990 klonte ein Team unter der Leitung von Tom Bonner und Miles Herkenham das CB1-Rezeptor-Gen bei Ratten und später beim Menschen und bestätigte, dass es sich um einen G-Protein-gekoppelten Rezeptor handelt – typisch für Neurotransmitter-Systeme. CB1-Rezeptoren erwiesen sich als einer der häufigsten im Gehirn und übertrafen sogar die Dichte von Serotonin- oder Dopaminrezeptoren.
Im Jahr 1993 entdeckte der britische Wissenschaftler Sean Munro einen zweiten Rezeptortyp – CB2, der hauptsächlich in peripheren Geweben, insbesondere in Immunzellen (Milz, Lymphknoten), vorkommt. Dies deutete darauf hin, dass Cannabinoide nicht nur das Gehirn, sondern auch das Immunsystem beeinflussen.
4. Endocannabinoide: Die inneren „THCs“
Die Entdeckung der Rezeptoren warf eine neue Frage auf: Wenn sie existieren, muss der Körper eigene Liganden (Substanzen, die an die Rezeptoren binden) produzieren. Im Jahr 1992 isolierte Raphael Mechoulam, der zur Cannabis-Thematik zurückkehrte, zusammen mit William Devane und Lumír Hanuš das erste Endocannabinoid – Anandamid (Arachidonoylethanolamid). Sie fanden es im Schweinegehirn mithilfe von Massenspektrometrie und Kernspinresonanz. Der Name „Anandamid“ stammt vom Sanskrit-Wort „Ananda“ (Glückseligkeit) und spiegelt seine Rolle bei der Stimmungsregulation wider.
Anandamid erwies sich als partieller Agonist der CB1-Rezeptoren und verursachte ähnliche, aber mildere und kurzfristigere Effekte wie THC. Im Jahr 1995 entdeckte ein anderes Team, darunter Vincenzo Di Marzo, das zweite Endocannabinoid – 2-Arachidonoylglycerol (2-AG), das sowohl für CB1 als auch für CB2 aktiv ist und im Körper in größeren Mengen vorkommt.
Endocannabinoide werden „auf Abruf“ aus Lipiden der Zellmembranen synthetisiert und schnell durch Enzyme wie FAAH (für Anandamid) und MAGL (für 2-AG) abgebaut. Dies unterscheidet sie von klassischen Neurotransmittern wie Dopamin, die in Vesikeln gespeichert werden.
5. Das Endocannabinoid-System: Synthese der Entdeckungen
Mitte der 1990er Jahre zeichnete sich das Bild des Endocannabinoid-Systems (ECS) als komplexes Netzwerk ab, das Folgendes umfasst:
Rezeptoren (CB1, CB2 und möglicherweise andere wie GPR55);
Endocannabinoide (Anandamid, 2-AG und weniger untersuchte Moleküle);
Enzyme für Synthese und Abbau (DAGL, NAPE-PLD, FAAH, MAGL).
Das ECS erwies sich als retrograder Signalmechanismus: Endocannabinoide werden von postsynaptischen Neuronen freigesetzt und beeinflussen präsynaptische Neuronen, indem sie die Freisetzung anderer Neurotransmitter (z. B. Glutamat oder GABA) regulieren. Dies erklärt ihre Rolle im Homöostase – der Aufrechterhaltung des Gleichgewichts im Körper.
6. Bedeutung
Die Entdeckung des ECS verband Cannabis mit der inneren Physiologie. THC und CBD wirken als exogene Modulatoren dieses Systems: THC aktiviert CB1 und verursacht psychoaktive Effekte, während CBD indirekt darauf einwirkt, indem es den Abbau von Endocannabinoiden hemmt oder mit anderen Rezeptoren (z. B. TRPV1) interagiert.
Heute wird das ECS im Kontext der Behandlung von Schmerzen, Epilepsie (z. B. das CBD-basierte Medikament Epidiolex), Stimmungsstörungen, Entzündungen und sogar Krebs untersucht. Studien deuten darauf hin, dass Störungen des ECS mit Depressionen, Fettleibigkeit und neurodegenerativen Erkrankungen zusammenhängen könnten.
Struktur des Endocannabinoid-Systems: Das dreifache Bündnis
1. Rezeptoren: die „Schlösser“ des Systems
Der erste Bestandteil des ECS sind die Cannabinoid-Rezeptoren, die als „Schlösser“ fungieren und auf passende „Schlüssel“ (Liganden) warten. Sie befinden sich auf Zellmembranen und reagieren auf Endocannabinoide sowie auf externe Substanzen wie THC aus Cannabis. Die Haupttypen von Rezeptoren sind:
CB1-Rezeptoren:
Lokalisation: Hauptsächlich im zentralen Nervensystem (ZNS) – Gehirn und Rückenmark. Eine hohe Dichte findet sich im Hippocampus (Gedächtnis), in den Basalganglien (Bewegung), in der Großhirnrinde (Denken) und im Kleinhirn (Koordination). Weniger davon gibt es in peripheren Geweben wie Herz oder Lunge.
Funktion: Sie regulieren die Neurotransmission, indem sie die Freisetzung von Neurotransmittern (z. B. Glutamat, Dopamin, GABA) hemmen oder verstärken. Dies erklärt ihre Rolle bei Stimmung, Schmerzempfindung und Appetit. CB1 ist auch für die psychoaktiven Wirkungen von THC verantwortlich.
Eigenschaften: Es handelt sich um G-Protein-gekoppelte Rezeptoren, die bei Aktivierung die Adenylatzyklase hemmen, den cAMP-Spiegel senken und Ionenkanäle (z. B. Kalium- und Kalziumkanäle) modulieren.
CB2-Rezeptoren:
Lokalisation: Hauptsächlich in peripheren Geweben, insbesondere im Immunsystem (Milz, Lymphknoten, Makrophagen), obwohl geringe Mengen auch im Gehirn (in der Mikroglia) gefunden wurden.
Funktion: Sie regulieren Immunreaktionen und Entzündungen. Die Aktivierung von CB2 kann die Freisetzung entzündungsfördernder Zytokine unterdrücken, was sie zu einem Ziel für die Behandlung chronischer entzündlicher Erkrankungen macht.
Eigenschaften: Wie CB1 sind sie G-Protein-gekoppelte Rezeptoren, aber ihre Aktivierung ist weniger mit psychoaktiven Effekten verbunden.
Andere Rezeptoren:
Es gibt Hinweise auf zusätzliche Akteure im ECS, wie GPR55 („dritter Cannabinoid-Rezeptor“), TRPV1 (Vanilloid-Rezeptor, der auf Wärme und Capsaicin reagiert) und PPAR (Rezeptoren, die mit dem Stoffwechsel verbunden sind). Ihre Rolle im ECS wird noch erforscht.
2. Endocannabinoide: die „Schlüssel“ des Systems
Der zweite Bestandteil sind die Endocannabinoide – Lipide, die vom Körper synthetisiert werden und an CB1- und CB2-Rezeptoren binden. Dies sind die „inneren Schlüssel“, die die Funktion des Systems steuern. Die Hauptvertreter sind:
Anandamid (AEA):
Struktur: Ein Derivat der Arachidonsäure (eine Omega-6-Fettsäure). Chemisch: N-Arachidonoylethanolamin.
Synthese: Wird „auf Abruf“ aus Phospholipiden der Zellmembran durch das Enzym N-Acylphosphatidylethanolamin-Phospholipase D (NAPE-PLD) gebildet.
Funktion: Partieller Agonist von CB1, schwacher Agonist von CB2. Beeinflusst Stimmung, Gedächtnis und Schmerzempfindung. Es wird als „Molekül der Glückseligkeit“ bezeichnet, wegen seiner Ähnlichkeit mit den Effekten von THC.
Abbau: Wird schnell durch das Enzym FAAH (Fettsäureamidhydrolase) in Arachidonsäure und Ethanolamin zerlegt, was seine Wirkungsdauer begrenzt.
2-Arachidonoylglycerol (2-AG):
Struktur: Ein Ester aus Arachidonsäure und Glycerin.
Synthese: Wird aus Diacylglycerol durch das Enzym Diacylglycerinlipase (DAGL) produziert, ebenfalls „auf Abruf“.
Funktion: Voller Agonist von CB1 und CB2. Häufiger im Körper als Anandamid und spielt eine Schlüsselrolle bei der Unterdrückung der synaptischen Übertragung und Entzündung.
Abbau: Wird durch das Enzym Monoacylglycerinlipase (MAGL) und teilweise durch FAAH in Arachidonsäure und Glycerin zerlegt.
Andere Endocannabinoide:
Weniger untersuchte Moleküle wie Virodhamin, Noladin-Ether und N-Arachidonoyldopamin (NADA) könnten ebenfalls mit dem ECS interagieren, aber ihre Funktionen sind noch nicht vollständig geklärt.
Eine Besonderheit der Endocannabinoide ist ihre retrograde Wirkung: Sie werden von postsynaptischen Neuronen freigesetzt und bewegen sich zu präsynaptischen Neuronen, um die synaptische Aktivität „rückwärts“ zu regulieren.
3. Enzyme: die „Kontroller“ des Systems
Der dritte Bestandteil sind die Enzyme, die Endocannabinoide synthetisieren und abbauen und so eine präzise und zeitliche Regulation gewährleisten. Sie fungieren als „Kontroller“, die das Gleichgewicht aufrechterhalten.
Synthese-Enzyme:
NAPE-PLD: Verwandelt Membranphospholipide in Anandamid.
DAGL: Verwandelt Diacylglycerol in 2-AG.
Diese Enzyme werden durch Stimuli wie einen Anstieg des Kalziumspiegels in der Zelle aktiviert.
Abbau-Enzyme:
FAAH: Baut Anandamid (und teilweise 2-AG) in Arachidonsäure und Ethanolamin ab. FAAH-Hemmer werden als potenzielle Medikamente untersucht, um die Effekte von Endocannabinoiden zu verstärken (z. B. bei Angst oder Schmerzen).
MAGL: Hauptverantwortlich für den Abbau von 2-AG in Arachidonsäure und Glycerin. Es ist für etwa 85 % des 2-AG-Abbaus im Gehirn verantwortlich.
Zusätzliche Wege:
Endocannabinoide können auch durch andere Enzyme wie Cyclooxygenase-2 (COX-2) metabolisiert werden, was das ECS mit der Prostaglandinsynthese und Entzündungen verbindet.
Das dreifache Bündnis in Aktion
Diese drei Komponenten arbeiten synchron:
1. Stimulus: Eine erhöhte Neuronenaktivität oder ein Entzündungssignal löst die Synthese von Endocannabinoiden aus.
2. Aktivierung: Endocannabinoide binden an CB1 oder CB2 und modulieren die synaptische Übertragung oder die Immunantwort.
3. Beendigung: Enzyme bauen die Endocannabinoide ab und verhindern deren übermäßige Ansammlung.
Beispiel: Nach Stress kann Anandamid CB1 im Hippocampus aktivieren, die übermäßige Glutamatfreisetzung unterdrücken und Angst reduzieren. Anschließend „schaltet“ FAAH das Signal schnell wieder ab.
Bedeutung der Struktur
Das „dreifache Bündnis“ macht das ECS zu einem einzigartigen System. Im Gegensatz zu klassischen Neurotransmittern (z. B. Serotonin), die in Vesikeln gespeichert und gerichtet freigesetzt werden, wirken Endocannabinoide lokal und kurzfristig, was ideal für die Feinabstimmung von Prozessen ist. Diese Struktur erklärt, warum externe Cannabinoide wie THC (ein CB1-Agonist) oder CBD (ein Enzymmodulator) den Körper so stark beeinflussen können.
Wirkmechanismus: Retrograde Signalübertragung
Das ECS unterscheidet sich von anderen Neurotransmitter-Systemen durch seine einzigartige Signalübertragung. Im Gegensatz zu klassischen Neurotransmittern, die von der präsynaptischen zur postsynaptischen Zelle wandern, arbeiten Endocannabinoide retrograd. Das bedeutet, sie werden in der postsynaptischen Zelle synthetisiert (als Reaktion auf Stimulation, z. B. einen Kalziumanstieg), durchqueren die synaptische Spalte und binden an Rezeptoren der präsynaptischen Zelle, um die Freisetzung von Neurotransmittern wie GABA oder Glutamat zu regulieren oder zu unterdrücken.
Dieser Prozess wird als depolarisationsinduzierte Unterdrückung der Erregung (DSE) oder Hemmung (DSI) bezeichnet, je nach Art des Neurotransmitters. Diese retrograde Signalübertragung macht das ECS zu einem leistungsstarken Werkzeug zur Feinabstimmung neuronaler Aktivität.Depolarisationsinduzierte Suppression der Erregung (DSE)
Die depolarisationsinduzierte Suppression der Erregung (Depolarization-induced Suppression of Excitation, DSE) ist eine spezifische Form der retrograden Signalübertragung im Endocannabinoid-System (ECS), bei der Endocannabinoide die Freisetzung von erregenden Neurotransmittern, wie Glutamat, aus präsynaptischen Neuronen vorübergehend reduzieren. Dieser Prozess spielt eine wichtige Rolle bei der Regulation der neuronalen Aktivität, der Verhinderung von Übererregbarkeit und der Aufrechterhaltung des synaptischen Gleichgewichts. Lassen Sie uns DSE im Detail betrachten: seinen Mechanismus, seine physiologische Bedeutung und den Kontext im ECS
1. Mechanismus von DSE: Schritt für Schritt
DSE findet im Rahmen der retrograden Signalübertragung des ECS statt und umfasst die folgenden Schritte:
Depolarisation des postsynaptischen Neurons:
Der Prozess beginnt mit der Aktivierung eines postsynaptischen Neurons, normalerweise durch den Eingang von Glutamat vom präsynaptischen Neuron. Dies führt zu einer Depolarisation der Membran – einer Änderung des Potentials von negativ zu positiver.
Die Depolarisation öffnet spannungsabhängige Kalziumkanäle (VDCC) oder aktiviert NMDA-Rezeptoren, was zu einem Einstrom von Kalzium (Ca²⁺) in die postsynaptische Zelle führt.
Die Erhöhung des Ca²⁺-Spiegels ist der entscheidende Auslöser für die Initiierung von DSE.
Synthese von Endocannabinoiden:
Der erhöhte Kalziumspiegel aktiviert Enzyme der Endocannabinoid-Synthese:
2-Arachidonoylglycerol (2-AG): Der Hauptakteur bei DSE, synthetisiert durch das Enzym Diacylglycerinlipase (DAGL) aus Diacylglycerin in der Membran.
Anandamid: Seltener beteiligt, kann aber durch das Enzym NAPE-PLD synthetisiert werden.
Endocannabinoide werden „auf Abruf“ als Reaktion auf Stimulation produziert und nicht im Voraus gespeichert.
Freisetzung und retrograde Bewegung:
Endocannabinoide (meist 2-AG) werden aus dem postsynaptischen Neuron in den synaptischen Spalt freigesetzt. Der Mechanismus ihrer Freisetzung ist nicht vollständig geklärt, es wird jedoch eine Diffusion durch die Lipidmembran oder die Beteiligung von Transportern vermutet.
Sie bewegen sich rückwärts zum präsynaptischen Neuron, wo sich CB1-Rezeptoren befinden.
Aktivierung von CB1-Rezeptoren:
Endocannabinoide binden an CB1-Rezeptoren an der präsynaptischen Membran – G-Protein-gekoppelte Rezeptoren.
Die Aktivierung von CB1 löst eine intrazelluläre Signalkaskade aus:
Hemmung der Adenylatzyklase, Reduktion des cAMP-Spiegels.
Öffnung von Kaliumkanälen (erhöhter K⁺-Ausstrom), was die präsynaptische Membran hyperpolarisiert.
Schließung von Kalziumkanälen (verminderter Ca²⁺-Einstrom), was die Wahrscheinlichkeit der Freisetzung von Glutamat-Vesikeln reduziert.
Unterdrückung der Glutamatfreisetzung:
Die Verringerung des Ca²⁺-Einstroms im präsynaptischen Neuron reduziert die Exozytose von Vesikeln, die Glutamat enthalten.
Infolgedessen wird das erregende Signal zum postsynaptischen Neuron vorübergehend geschwächt – das ist DSE.
Die Dauer der Unterdrückung beträgt in der Regel einige Sekunden bis zu einer Minute, abhängig von der Stärke des Stimulus und der Konzentration der Endocannabinoide.
Abschluss des Prozesses:
Nach ihrer Rolle werden Endocannabinoide durch Enzyme abgebaut: 2-AG durch Monoacylglycerinlipase (MAGL), Anandamid durch FAAH.
Der schnelle Abbau sorgt für die Kurzlebigkeit des DSE-Effekts.
2. Bedingungen für das Auftreten von DSE
DSE hängt von mehreren Faktoren ab:
Kalziumspiegel: Eine signifikante Erhöhung von Ca²⁺ (meist über VDCC) ist erforderlich, was DSE weniger empfindlich macht als DSI, wo der Aktivierungsschwellenwert niedriger ist.
Synapsentyp: DSE wird häufiger in glutamatergen (erregenden) Synapsen beobachtet, wie z. B. in Synapsen der Purkinje-Zellen im Kleinhirn oder der Pyramidenneuronen im Hippocampus.
Stimulusdauer: Eine starke und längere Depolarisation (z. B. 100 ms oder mehr) verstärkt DSE.
3. Physiologische Bedeutung von DSE
DSE spielt eine wichtige Rolle in der neuronalen Regulation:
Kontrolle der Übererregbarkeit: Durch die Unterdrückung einer übermäßigen Glutamatfreisetzung verhindert DSE eine übermäßige Stimulation der Neuronen, was als Schutzmechanismus bei Epilepsie oder Stress dienen kann.
Synaptische Plastizität: DSE ist an kurzfristiger und langfristiger Depression (LTD) von Synapsen beteiligt und beeinflusst Lernen und Gedächtnis. Im Kleinhirn hilft DSE beispielsweise, die Bewegungskoordination zu regulieren, indem es die Aktivität der Purkinje-Zellen moduliert.
Homöostase: Es hält das Gleichgewicht zwischen Erregung und Hemmung in neuronalen Netzwerken aufrecht und verhindert eine „Überhitzung“ des Systems.
Beispiel: Im Kleinhirn synthetisiert eine stark aktivierte Purkinje-Zelle 2-AG, das die weitere Glutamatfreisetzung von parallelen Fasern unterdrückt und so eine präzise Feinabstimmung der motorischen Funktion ermöglicht.
4. Vergleich mit DSI
Obwohl DSE und DSI beide retrograde Signalübertragung über CB1 nutzen, unterscheiden sie sich:
Neurotransmitter-Typ: DSE unterdrückt Glutamat (Erregung), DSI unterdrückt GABA (Hemmung).
Empfindlichkeit: DSI ist einfacher zu induzieren (erfordert weniger Ca²⁺-Anstieg) als DSE.
Lokalisation: DSI tritt häufiger im Hippocampus und Kortex auf, DSE im Kleinhirn und anderen glutamatergen Bereichen.
Diese Unterschiede spiegeln die Anpassungsfähigkeit des ECS an verschiedene Synapsentypen und Aufgaben wider.
5. Experimentelle Beweise
DSE wurde erstmals 2001 in Arbeiten von Michael Mauk und Roger Nicoll nachgewiesen. In Experimenten mit Kleinhirnschnitten von Ratten zeigten sie, dass die Depolarisation von Purkinje-Zellen eine vorübergehende Verringerung der Amplitude erregender postsynaptischer Potentiale (EPSP) von parallelen Fasern verursacht. Der Effekt wurde durch CB1-Antagonisten (z. B. AM251) blockiert, was die Rolle der Endocannabinoide bestätigt.
Später wurde DSE im Hippocampus, Kortex und anderen Regionen bestätigt, was seine Universalität unterstreicht.
6. Verbindung zu externen Cannabinoiden
THC aus Cannabis kann DSE verstärken oder imitieren, indem es CB1-Rezeptoren aktiviert und die Glutamatfreisetzung unterdrückt, was teilweise seine sedativen Effekte erklärt. CBD, das den Abbau von Endocannabinoiden beeinflusst (z. B. durch Hemmung von MAGL), kann natürliches DSE verstärken und zur Entspannung beitragen, ohne psychoaktive Wirkung.
7. Bedeutung für die Forschung
DSE ist nicht nur ein physiologischer Prozess, sondern auch ein Modell zur Untersuchung des ECS. Seine Erforschung hilft, Mechanismen der synaptischen Plastizität, neurologischer Störungen (z. B. Epilepsie) und der Wirkung von Cannabinoid-Medikamenten zu verstehen.
Funktionen des Endocannabinoid-Systems: Ein universeller Regulator
Das ECS trägt zur Aufrechterhaltung der Homöostase bei, indem es auf innere und äußere Veränderungen reagiert. Sein Einfluss erstreckt sich auf nahezu alle Körpersysteme. Schauen wir uns die Hauptfunktionen im Detail an:
1. Schmerzregulierung
Das ECS moduliert sowohl akute als auch chronische Schmerzen. CB1-Rezeptoren im Rückenmark und peripheren Nerven reduzieren die Schmerzsignalübertragung, während CB2-Rezeptoren in Immunzellen Entzündungen lindern, die Schmerzen oft verstärken. Bei Verletzungen steigt beispielsweise der 2-AG-Spiegel im Gewebe, um Beschwerden zu mildern.
2. Emotionen und Stress
Anandamid aktiviert CB1-Rezeptoren in der Amygdala und der präfrontalen Cortex – Bereiche des Gehirns, die für Emotionen und Entscheidungen verantwortlich sind. Ein niedriger Anandamidspiegel wird mit erhöhter Angst und Depression in Verbindung gebracht. Das ECS reguliert auch die Hypothalamus-Hypophysen-Nebennieren-Achse (HPA), die die Stressreaktion steuert.
3. Schlaf und zirkadiane Rhythmen
Die Aktivierung von CB1-Rezeptoren fördert Entspannung und den Übergang in die Tiefschlafphase. Studien zeigen, dass Endocannabinoide die Synchronisation der zirkadianen Rhythmen über das suprachiasmatische Nucleus im Hypothalamus beeinflussen.
4. Appetit und Verdauung
CB1-Rezeptoren im Hypothalamus und im Magen-Darm-Trakt stimulieren den Appetit und regulieren die Darmmotilität. Dies erklärt, warum THC Hunger auslöst und CB1-Hemmer (z. B. Rimonabant) den Appetit unterdrücken.
5. Immunsystem und Entzündung
CB2-Rezeptoren in Makrophagen, T-Zellen und Mikroglia hemmen die Freisetzung entzündungsfördernder Zytokine (z. B. IL-6, TNF-α), was das ECS zu einem wichtigen Akteur bei der Bekämpfung chronischer Entzündungen und Autoimmunerkrankungen macht.
6. Neuroplastizität und Gedächtnis
Das ECS reguliert die synaptische Plastizität – die Fähigkeit von Neuronen, neue Verbindungen zu bilden. Dies ist entscheidend für das Lernen, aber eine übermäßige Aktivierung von CB1-Rezeptoren (z. B. durch Cannabis) kann das Kurzzeitgedächtnis vorübergehend beeinträchtigen, indem die Informationskonsolidierung im Hippocampus blockiert wird.
7. Fortpflanzungssystem
Endocannabinoide beeinflussen die Synthese von Geschlechtshormonen und spielen eine Rolle bei der Implantation des Embryos. CB1-Rezeptoren sind in Eierstöcken, Gebärmutter und Spermien vorhanden.
8. Temperaturregulierung und Stoffwechsel
Das ECS reguliert die Körpertemperatur über den Hypothalamus und beeinflusst die Lipogenese (Fettansammlung) sowie den Glukosestoffwechsel in peripheren Geweben.
Verbindung mit Cannabis: Phytocannabinoide und das Endocannabinoid-System (ECS)
Das Endocannabinoid-System (ECS) interagiert eng mit den Inhaltsstoffen von Cannabis, insbesondere den Phytocannabinoiden wie THC (Tetrahydrocannabinol) und CBD (Cannabidiol). Diese pflanzlichen Verbindungen beeinflussen das ECS, indem sie dessen Rezeptoren aktivieren oder modulieren und die Konzentration endogener Cannabinoide verändern. Diese Wechselwirkung erklärt viele der pharmakologischen und therapeutischen Effekte von Cannabis. Lassen Sie uns die Verbindung zwischen Phytocannabinoiden und dem ECS genauer untersuchen.
1. Was sind Phytocannabinoide?
Phytocannabinoide sind natürliche Verbindungen, die in der Cannabispflanze (Cannabis sativa) vorkommen. Über 100 verschiedene Phytocannabinoide wurden identifiziert, wobei THC und CBD die bekanntesten und am besten erforschten sind. Sie ähneln strukturell den Endocannabinoiden (z. B. 2-AG und Anandamid), die der Körper selbst produziert, und können daher mit den Rezeptoren des ECS interagieren.
2. Wirkung von THC auf das ECS
THC ist das psychoaktive Hauptcannabinoid in Cannabis und wirkt als partieller Agonist an CB1- und CB2-Rezeptoren. • CB1-Rezeptoren: THC bindet stark an CB1-Rezeptoren im Gehirn (z. B. Hippocampus, Kleinhirn, Kortex), was seine psychoaktiven Effekte erklärt, wie Euphorie, veränderte Wahrnehmung und Gedächtnisbeeinträchtigung. Es imitiert Anandamid, jedoch mit stärkerer und länger anhaltender Wirkung.
DSE-ähnliche Effekte: Durch die Aktivierung von CB1 an präsynaptischen Neuronen unterdrückt THC die Glutamatfreisetzung, ähnlich wie bei der depolarisationsinduzierten Suppression der Erregung (DSE). Dies führt zu einer sedativen Wirkung und kann Übererregbarkeit (z. B. bei Epilepsie) reduzieren.
CB2-Rezeptoren: THC aktiviert auch CB2 in peripheren Geweben und Immunzellen, was entzündungshemmende Effekte hat.
Nebenwirkungen: Die starke Aktivierung von CB1 kann Angst, Paranoia oder Tachykardie auslösen, insbesondere bei hohen Dosen.
3. Wirkung von CBD auf das ECS
CBD ist nicht psychoaktiv und hat eine komplexere, indirektere Wirkung auf das ECS. Es bindet nur schwach an CB1- und CB2-Rezeptoren, wirkt jedoch auf andere Weise:
Hemmung des Endocannabinoid-Abbaus: CBD hemmt Enzyme wie FAAH (verantwortlich für den Abbau von Anandamid) und MAGL (für 2-AG). Dies erhöht die Konzentration von Endocannabinoiden im Körper und verstärkt natürliche Prozesse wie DSE oder DSI.
Allosterische Modulation: CBD kann die Aktivität von CB1-Rezeptoren modulieren, indem es als negatives allosterisches Modulans wirkt, was die Wirkung von THC abmildern kann.
Andere Rezeptoren: CBD interagiert mit Nicht-ECS-Rezeptoren wie TRPV1 (Schmerz- und Entzündungsregulation) und 5-HT1A (Serotoninrezeptoren, anxiolytische Effekte), was seine Vielseitigkeit erklärt.
Therapeutische Effekte: CBD wird für seine angstlindernden, entzündungshemmenden und antikonvulsiven Eigenschaften geschätzt (z. B. bei Epilepsie wie Dravet-Syndrom).
4. Synergie zwischen THC und CBD (Entourage-Effekt)
Der sogenannte „Entourage-Effekt“ beschreibt die synergistische Wirkung von THC, CBD und anderen Cannabis-Inhaltsstoffen (z. B. Terpenen).
Modulation: CBD kann die psychoaktiven Nebenwirkungen von THC reduzieren, indem es dessen Bindung an CB1 abschwächt und die anxiolytischen Effekte verstärkt.
Breiteres Wirkungsspektrum: Die Kombination von Phytocannabinoiden mit Endocannabinoiden und anderen Molekülen (z. B. Flavonoiden) kann die therapeutische Wirkung verbessern, z. B. bei Schmerztherapie oder Entzündungskontrolle.
5. Vergleich: Phytocannabinoide vs. Endocannabinoide
Produktion: Endocannabinoide wie 2-AG und Anandamid werden „auf Abruf“ im Körper synthetisiert und schnell abgebaut, während Phytocannabinoide extern zugeführt werden und länger im System verbleiben.
Spezifität: Endocannabinoide wirken gezielt und lokal (retrograde Signalübertragung), während THC und CBD systemischere Effekte haben.
Potenz: THC ist potenter als Anandamid an CB1, während CBD die natürliche ECS-Aktivität subtiler verstärkt.
6. Therapeutische Relevanz
Die Verbindung zwischen Cannabis und dem ECS hat bedeutende medizinische Implikationen:
Schmerztherapie: THC und CBD lindern chronische Schmerzen durch CB1/CB2-Aktivierung und Entzündungshemmung.
Neurologische Erkrankungen: THC kann Muskelspasmen (z. B. bei Multipler Sklerose) entgegenwirken, während CBD bei Epilepsie (Epidiolex) zugelassen ist.
Psychische Gesundheit: CBD zeigt Potenzial bei Angststörungen und PTSD, während THC bei Depression oder Appetitlosigkeit hilfreich sein kann.
Nebenwirkungen: Die langfristige Nutzung von THC kann zu Toleranz oder Abhängigkeit führen, was die Rolle des ECS bei Suchtverhalten unterstreicht.
7. Evolutionäre Perspektive
Die strukturelle Ähnlichkeit zwischen Phytocannabinoiden und Endocannabinoiden deutet auf eine evolutionäre Verbindung hin. Es wird vermutet, dass Cannabispflanzen diese Verbindungen entwickelt haben, um Pflanzenfresser oder Pathogene abzuwehren, während das ECS bei Wirbeltieren als universelles Regulationssystem entstand. Die menschliche Nutzung von Cannabis nutzt diese „biologische Kompatibilität“ aus.
Autorin: Dr.med Olena Orlova