Diabetes
8. Februar 2025
Diabetes, formaler als Diabetes mellitus bekannt, ist eine Gruppe von Stoffwechselkrankheiten, die durch hohe Blutzuckerspiegel (Hyperglykämie) gekennzeichnet sind, die durch Störungen in der Produktion oder Wirkung von Insulin entstehen – einem Hormon, das von der Bauchspeicheldrüse produziert wird, um den Blutzuckerspiegel zu regulieren. Diabetes beeinflusst nicht nur den Stoffwechsel, sondern kann auch zu langfristigen Schäden, Funktionsstörungen und Insuffizienz verschiedener Organe führen, insbesondere der Nerven, Augen, Nieren und des Herz-Kreislauf-Systems.
Die Häufigsten Typen von Diabetes
Typ-1-Diabetes
• Insulin und Glukose: Insulin, das von den Betazellen der Langerhans-Inseln in der Bauchspeicheldrüse produziert wird, fungiert als "Schlüssel", der die Zellen öffnet, um Glukose aufzunehmen. Bei Typ-1-Diabetes wird dieses regulierende Wirken gestört.
• Autoimmunmechanismus: T-Lymphozyten, Teil des Immunsystems, beginnen, die Betazellen anzugreifen, was zu ihrem allmählichen Tod führt. Dieser Prozess kann Jahre vor dem Auftreten klinischer Symptome beginnen.
• Genetische Prädisposition: Einige Genvarianten (HLA-DQ und HLA-DR) sind mit einem erhöhten Risiko verbunden. Allerdings bedeutet das Vorhandensein dieser Gene nicht zwingend, dass die Krankheit ausbricht, da ein äußerer Auslöser erforderlich ist.
• Umweltbedingte Auslöser: Virale Infektionen (z.B. Enteroviren), diätetische Faktoren (frühe Einführung von Kuhmilch), oder sogar das Darmmikrobiom können den autoimmunen Prozess auslösen.
Typ-2-Diabetes
Gestationsdiabetes :
Ätiologie und Pathogenese
• Hormonelle Veränderungen: Die Plazenta produziert Hormone, die die Zellen weniger empfindlich für Insulin machen. Dies wird als Insulinresistenz bezeichnet.
• Beta-Zellenfunktion: Während der Schwangerschaft muss die Bauchspeicheldrüse mehr Insulin produzieren, um die erhöhte Belastung zu bewältigen. Kann sie dies nicht, entwickelt sich GD.
Risikofaktoren
• Vorheriger GD: Frauen, die in früheren Schwangerschaften GD hatten, haben ein hohes Risiko für Wiederholung.
• Übergewicht: Übergewicht vor der Schwangerschaft erhöht das Risiko erheblich.
• Familienanamnese: Es gibt eine genetische Prädisposition für Diabetes.
• Alter: Frauen über 25 Jahre haben ein höheres Risiko.
• Ethnische Zugehörigkeit: Bestimmte ethnische Gruppen haben ein erhöhtes Risiko, darunter Afroamerikaner, Lateinamerikaner, Ureinwohner, Südasier.
• Mehrlingsschwangerschaft: Das Vorhandensein von Zwillingen oder mehr erhöht das Risiko.
• Geburt eines großen Kindes zuvor: Eine Vorgeschichte der Geburt eines Kindes mit einem Gewicht über 4 kg.
• Polyhydramnion: Ein übermäßiges Maß an Fruchtwasser kann ebenfalls mit GD verbunden sein.
Diagnose
• Screening-Test: Der Glukose-Toleranz-Test (GCT) kann in der 24.-28. Schwangerschaftswoche durchgeführt werden. Bei positivem Ergebnis folgt:
o Oraler Glukosetoleranztest (OGTT): Beginnt mit der Messung des Blutzuckers auf nüchternen Magen, dann nach Einnahme von 75 g Glukose nach 1 und 2 Stunden gemessen. Die Diagnose wird gestellt, wenn mindestens ein Wert die folgenden Schwellenwerte überschreitet: nüchtern ≥ 5,1 mmol/l (92 mg/dl), nach 1 Stunde ≥ 10,0 mmol/l (180 mg/dl), nach 2 Stunden ≥ 8,5 mmol/l (153 mg/dl).
Symptome
GD ist oft asymptomatisch, aber es können auftreten:
• Erhöhte Durst
• Häufiges Wasserlassen
• Müdigkeit
• Unscharfe Sicht
Therapie
• Ernährungskontrolle: Ausgewogene Ernährung mit Schwerpunkt auf Kohlenhydratkontrolle, erhöhtem Ballaststoffverzehr, regelmäßigen Mahlzeiten.
• Körperliche Aktivität: Empfohlen werden geeignete Übungen zur Aufrechterhaltung des Blutzuckerspiegels.
• Blutzuckermonitoring: Regelmäßige Überprüfung des Blutzuckers.
• Medikamentöse Therapie: Wenn Diät und Bewegung den Blutzucker nicht kontrollieren, können Insulin oder orale Antidiabetika (in einigen Ländern) erforderlich sein.
• Erziehung: Wichtig ist die Schulung im Management von Diabetes, das Erkennen von Symptomen von Hypo- und Hyperglykämie.
Auswirkungen auf Mutter und Kind
• Für die Mutter: Erhöhtes Risiko für Bluthochdruck, Präeklampsie, Kaiserschnitt, Infektionen, postpartalen Diabetes.
• Für das Kind: Makrosomie (großes Kind), Hypoglykämie nach der Geburt, erhöhtes Risiko für Übergewicht und Diabetes in der Zukunft.
Nach der Geburt
• Postpartales Screening: Frauen mit GD sollten 6-12 Wochen nach der Geburt einen Diabetes-Test machen.
• Langfristige Risiken: Erhöhtes Risiko für die Entwicklung von Typ-2-Diabetes, Notwendigkeit regelmäßiger Gesundheitsüberprüfungen.
Prophylaxe
Obwohl es nicht möglich ist, GD vollständig zu verhindern, kann das Risiko reduziert werden:
• Aufrechterhaltung eines gesunden Gewichts vor der Schwangerschaft.
• Gesundheitsbewusster Lebensstil mit regelmäßiger Bewegung und ausgewogener Ernährung.
Typ-1-Diabetes
Pathophysiologie
1. Autoimmunprozess: Typ-1-Diabetes (T1D) entsteht, wenn das Immunsystem fälschlicherweise die Betazellen der Bauchspeicheldrüse angreift und zerstört, die Insulin produzieren. Dieser Prozess kann durch folgendes ausgelöst werden:
o Genetische Faktoren: Bestimmte Gene machen Menschen anfälliger für T1D.
o Virale Infektionen: Zum Beispiel können Enteroviren als Auslöser für die Aktivierung einer Autoimmunreaktion dienen.
o Andere Umweltfaktoren: Zum Beispiel Ernährungsfaktoren in der frühen Kindheit.
2. Zerstörung der Betazellen: Infolge des Autoimmunangriffs kommt es zu einer fortschreitenden Zerstörung der Betazellen, was zu einer Reduktion oder einem vollständigen Stopp der Insulinproduktion führt.
3. Hyperglykämie: Ohne ausreichend Insulin kann Glukose nicht effizient in die Zellen transportiert werden, um als Energie genutzt zu werden, was zur Anhäufung von Glukose im Blut führt.
4. Ketoazidose: In Abwesenheit von Insulin beginnt der Körper, Fette zur Energiegewinnung zu nutzen, was zur Bildung von Ketonen führt, die sich im Blut ansammeln können und eine lebensbedrohliche diabetische Ketoazidose verursachen.
Typ-2-Diabetes
Pathophysiologie
1. Insulinresistenz: Der Hauptmechanismus der Entwicklung von Typ-2-Diabetes (T2D) besteht darin, dass die Körperzellen weniger empfindlich auf Insulin reagieren, was bedeutet, dass der Körper mehr Insulin benötigt, damit Glukose in die Zellen gelangen kann.
o Faktoren der Insulinresistenz: Fettleibigkeit, insbesondere abdominale Fettleibigkeit, Mangel an körperlicher Aktivität, eine Ernährung mit hohem Zucker- und Fettgehalt, Alter, genetische Prädisposition.
2. Reduzierte Insulinproduktion: Mit der Zeit kann die Bauchspeicheldrüse erschöpft werden, da sie mehr Insulin produzieren muss, was zu einer reduzierten Insulinproduktion führt, selbst wenn dies notwendig ist.
3. Hyperglykämie: Als Folge der Kombination aus Insulinresistenz und unzureichender Insulinproduktion steigt der Blutzuckerspiegel.
4. Betazellendysfunktion: Chronische Hyperglykämie und Insulinresistenz können zu einer weiteren Verschlechterung der Betazellenfunktion führen, was einen Teufelskreis schafft.
Gestationsdiabetes
Pathophysiologie
1. Hormonelle Veränderungen: Während der Schwangerschaft produziert die Plazenta Hormone (z.B. humanes Laktogen), die der Wirkung von Insulin entgegenwirken (Insulinresistenz), um eine ausreichende Glukoseversorgung für den Fötus zu gewährleisten.
2. Unzureichende Kompensation: Wenn die Bauchspeicheldrüse nicht genug Insulin produzieren kann, um diese Insulinresistenz zu überwinden, entwickelt sich Gestationsdiabetes.
3. Hyperglykämie: Infolgedessen steigt der Blutzuckerspiegel der Mutter, was das Wachstum und die Entwicklung des Fötus beeinflussen kann.
Allgemeine Mechanismen der Diabetesentwicklung umfassen:
• Genetische Faktoren: Beeinflussen die Anfälligkeit für Diabetes.
• Metabolischer Stress: Wie Fettleibigkeit, die die Belastung der Glukosekontrollmechanismen erhöht.
• Entzündliche Prozesse: Chronische Entzündungen können zur Insulinresistenz und Betazellendysfunktion beitragen.
• Epigenetische Veränderungen: Können die Fähigkeit des Körpers, Glukose zu managen, ohne Änderungen in der DNA modifizieren.
Risikofaktoren
Gemeinsame Risikofaktoren für Typ-1- und Typ-2-Diabetes:
• Genetische Prädisposition: Verwandte ersten Grades mit Diabetes erhöhen das Risiko.
• Ethnische Zugehörigkeit: Hohes Risiko bei Afroamerikanern, Lateinamerikanern, Ureinwohnern, Asiaten, Polynesiern.
Spezifische Risikofaktoren für Typ-1-Diabetes (T1D):
• Alter: Obwohl T1D in jedem Alter auftreten kann, wird er häufiger bei Kindern, Jugendlichen und jungen Erwachsenen diagnostiziert.
• Genetische Marker: Einige Gene (HLA-DQ und HLA-DR) sind mit einem erhöhten Risiko verbunden.
• Virale Infektionen: Einige Viren, wie Enteroviren, können ein Auslöser sein.
• Diätetische Faktoren: Frühe Einführung von Kuhmilch oder ein Mangel an Vitamin D können mit dem Risiko verbunden sein.
• Geografischer Standort: Höher in nördlichen Breiten, was möglicherweise mit weniger Sonnenlicht und Vitamin D verbunden ist.
Spezifische Risikofaktoren für Typ-2-Diabetes (T2D):
• Alter: Das Risiko steigt mit dem Alter, besonders nach 45 Jahren.
• Übergewicht: Besonders Bauchfett ist ein Schlüsselrisikofaktor.
• Körperliche Aktivität: Ein sitzender Lebensstil erhöht das Risiko.
• Geschichte von Gestationsdiabetes: Frauen mit Gestationsdiabetes haben ein erhöhtes Risiko, T2D zu entwickeln.
• Bluthochdruck: Hoher Blutdruck ist mit einem höheren Risiko verbunden.
• Dyslipidämie: Niedriger HDL-Cholesterinspiegel, hoher Triglyzeridspiegel.
• Geschichte der Geburt eines großen Kindes: Geburt eines Kindes mit einem Gewicht über 4 kg.
• Polycystisches Ovarialsyndrom (PCOS): Frauen mit PCOS haben ein höheres Risiko für T2D.
• Metabolisches Syndrom: Kombination von Übergewicht, hohem Blutdruck, hohem Blutzuckerspiegel, abnormalen Cholesterinwerten.
Risikofaktoren für Gestationsdiabetes:
• Vorheriger Gestationsdiabetes: Hohes Risiko für Wiederholung in nachfolgenden Schwangerschaften.
• Übergewicht vor der Schwangerschaft: Erhöht das Risiko erheblich.
• Alter: Frauen über 25 Jahre haben ein höheres Risiko.
• Familienanamnese von Diabetes: Besonders wenn Eltern oder Geschwister Diabetes haben.
• Mehrlingsschwangerschaft: Das Vorhandensein von Zwillingen oder mehr erhöht das Risiko.
• Geschichte der Geburt eines großen Kindes: Geburt eines Kindes mit einem Gewicht über 4 kg in einer früheren Schwangerschaft.
• Polycystisches Ovarialsyndrom: Frauen mit PCOS haben ein erhöhtes Risiko.
• Ethnische Zugehörigkeit: Dieselben Gruppen wie bei T2D haben ein erhöhtes Risiko.
Diagnose
Die Diagnose von Diabetes umfasst mehrere Schritte und Tests, die darauf abzielen, den Blutzuckerspiegel zu bestimmen, was entscheidend für die Diagnosestellung ist. Hier ist eine detaillierte Übersicht der Diagnosemethoden für die verschiedenen Diabetesarten:
Allgemeine Tests zur Diagnose von Diabetes
1. Blutzucker nüchtern (Fasting Blood Glucose, FBG):
o Der Test wird nach einem 8-stündigen Fasten (normalerweise über Nacht) durchgeführt.
o Die Diagnose Diabetes wird gestellt, wenn der Blutzuckerwert ≥ 7,0 mmol/l (126 mg/dl) in zwei getrennten Messungen erreicht wird.
2. Oraler Glukosetoleranztest (OGTT, Oral Glucose Tolerance Test):
o Nach der Messung des Blutzuckerspiegels nüchtern trinkt der Patient eine Lösung, die 75 g Glukose enthält.
o Nach 2 Stunden wird der Blutzucker wieder gemessen. Die Diagnose Diabetes wird gestellt, wenn der Wert 11,1 mmol/l (200 mg/dl) ist.
3. Glykiertes Hämoglobin (HbA1c):
o Spiegel den durchschnittlichen Blutzuckerspiegel über die letzten 2-3 Monate wider.
o Die Diagnose Diabetes wird bei HbA1c ≥ 6,5% gestellt.
o Vorteile umfassen, dass kein Fasten erforderlich ist und nur ein Arztbesuch für den Test nötig ist.
4. Zufälliger Blutzucker-Test:
o Kann in Notfällen oder bei Vorhandensein klassischer Symptome von Diabetes verwendet werden. Die Diagnose wird bei einem Wert ≥ 11,1 mmol/l (200 mg/dl) in Kombination mit Hyperglykämiesymptomen gestellt.
Spezifische Überlegungen zur Diagnose:
• Typ-1-Diabetes:
o Oft diagnostiziert bei akutem Beginn mit Symptomen von Hyperglykämie, möglicherweise mit Ketoazidose. Zusätzliche Tests auf Autoantikörper gegen Inselzellen (ICA), Insulin (IAA), Glutaminsäure-Decarboxylase (GAD65), oder IA-2 können durchgeführt werden, um den autoimmunen Prozess zu bestätigen.
• Typ-2-Diabetes:
o Wird in der Regel diagnostiziert bei fehlenden Symptomen oder leichten Symptomen, durch Screening-Programme oder während regulärer medizinischer Untersuchungen. Der Hauptfokus liegt auf FBG, OGTT oder HbA1c.
• Gestationsdiabetes:
o Normalerweise zwischen der 24. und 28. Schwangerschaftswoche diagnostiziert:
Screening-Test: Eine einstündige Test mit 50 g Glukose, wenn der Blutzuckerwert ≥ 7,8 mmol/l (140 mg/dl) erreicht, wird ein OGTT durchgeführt.
OGTT: Nach der Einnahme von 75 g Glukose wird die Diagnose gestellt, wenn mindestens ein Wert überschritten ist:
Nüchtern ≥ 5,1 mmol/l (92 mg/dl)
Nach 1 Stunde ≥ 10,0 mmol/l (180 mg/dl)
Nach 2 Stunden ≥ 8,5 mmol/l (153 mg/dl)
Weitere Aspekte der Diagnose:
• Antikörpertests: Nützlich zur Differenzierung zwischen Diabetesarten, besonders bei jungen Menschen, bei denen Typ-1-Diabetes vermutet wird.
• Differenzialdiagnose: Es ist wichtig, andere Zustände auszuschließen, die einen erhöhten Blutzuckerspiegel verursachen können, wie einige hormonelle Störungen, Medikamenteneffekte oder Stresszustände.
• Überwachung: Nach der Diagnosestellung wechseln Patienten häufig zu regelmäßiger Überwachung des Blutzuckers mit Glukometern oder Systemen zur kontinuierlichen Glukoseüberwachung (CGM), um die Erkrankung zu managen.
Wann sollte eine Diagnose durchgeführt werden:
• Bei Vorhandensein von Hyperglykämiesymptomen.
• Bei hohem Risiko basierend auf Familiengeschichte, Übergewicht, Alter oder anderen Risikofaktoren.
• Während der Schwangerschaft zur Screening auf Gestationsdiabetes.
• Im Rahmen regulärer medizinischer Untersuchungen für Personen mit Risikofaktoren.
Blutzuckermonitoring: Verwendung von Glukosemessgeräten, kontinuierlichen Glukosemesssystemen.
Lebensstil: Diät mit Kohlenhydratkontrolle, regelmäßige körperliche Aktivität, Rauchen aufgeben, Stressmanagement.
Komplikationen
Mikrovaskulär: Schäden an kleinen Gefäßen führen zu diabetischer Nephropathie, Retinopathie, Neuropathie.
Makrovaskulär: Erhöhtes Risiko für Atherosklerose, koronare Herzkrankheit, Schlaganfall.
Andere: Diabetischer Fuß, Störungen der Immunfunktion, erhöhtes Infektionsrisiko.
Prävention
Primär: Gewichtskontrolle, gesunde Ernährung, aktiver Lebensstil, besonders für Risikogruppen.
Sekundär: Früherkennung und Management von Diabetes zur Vermeidung von Komplikationen.
Die Häufigsten Typen von Diabetes
Typ-1-Diabetes
• Insulin und Glukose: Insulin, das von den Betazellen der Langerhans-Inseln in der Bauchspeicheldrüse produziert wird, fungiert als "Schlüssel", der die Zellen öffnet, um Glukose aufzunehmen. Bei Typ-1-Diabetes wird dieses regulierende Wirken gestört.
• Autoimmunmechanismus: T-Lymphozyten, Teil des Immunsystems, beginnen, die Betazellen anzugreifen, was zu ihrem allmählichen Tod führt. Dieser Prozess kann Jahre vor dem Auftreten klinischer Symptome beginnen.
• Genetische Prädisposition: Einige Genvarianten (HLA-DQ und HLA-DR) sind mit einem erhöhten Risiko verbunden. Allerdings bedeutet das Vorhandensein dieser Gene nicht zwingend, dass die Krankheit ausbricht, da ein äußerer Auslöser erforderlich ist.
• Umweltbedingte Auslöser: Virale Infektionen (z.B. Enteroviren), diätetische Faktoren (frühe Einführung von Kuhmilch), oder sogar das Darmmikrobiom können den autoimmunen Prozess auslösen.
Typ-2-Diabetes
Typ-2-Diabetes (T2D), früher als "Altersdiabetes" oder "nicht-insulinabhängiger Diabetes" bekannt, wird durch einen hohen Blutzuckerspiegel aufgrund von Problemen bei der Nutzung von Insulin oder seiner unzureichenden Produktion charakterisiert. Im Gegensatz zum Typ-1-Diabetes, bei dem der Körper kein Insulin produziert, kann bei T2D Insulin in ausreichenden Mengen produziert werden, aber die Körperzellen werden gegen seine Wirkung resistent. Mit der Zeit, wenn der Diabetes nicht kontrolliert wird, kann die Bauchspeicheldrüse die Insulinproduktion reduzieren.
Gestationsdiabetes :
Gestationsdiabetes (GD) ist ein Zustand, bei dem eine Frau während der Schwangerschaft zum ersten Mal einen hohen Blutzuckerspiegel entwickelt, normalerweise nach der 20. Woche. Obwohl er oft nach der Geburt verschwindet, birgt er erhebliche Risiken für die Gesundheit von Mutter und Kind während der Schwangerschaft und kann ein Vorbote für Typ-2-Diabetes später im Leben sein.
Ätiologie und Pathogenese
• Hormonelle Veränderungen: Die Plazenta produziert Hormone, die die Zellen weniger empfindlich für Insulin machen. Dies wird als Insulinresistenz bezeichnet.
• Beta-Zellenfunktion: Während der Schwangerschaft muss die Bauchspeicheldrüse mehr Insulin produzieren, um die erhöhte Belastung zu bewältigen. Kann sie dies nicht, entwickelt sich GD.
Risikofaktoren
• Vorheriger GD: Frauen, die in früheren Schwangerschaften GD hatten, haben ein hohes Risiko für Wiederholung.
• Übergewicht: Übergewicht vor der Schwangerschaft erhöht das Risiko erheblich.
• Familienanamnese: Es gibt eine genetische Prädisposition für Diabetes.
• Alter: Frauen über 25 Jahre haben ein höheres Risiko.
• Ethnische Zugehörigkeit: Bestimmte ethnische Gruppen haben ein erhöhtes Risiko, darunter Afroamerikaner, Lateinamerikaner, Ureinwohner, Südasier.
• Mehrlingsschwangerschaft: Das Vorhandensein von Zwillingen oder mehr erhöht das Risiko.
• Geburt eines großen Kindes zuvor: Eine Vorgeschichte der Geburt eines Kindes mit einem Gewicht über 4 kg.
• Polyhydramnion: Ein übermäßiges Maß an Fruchtwasser kann ebenfalls mit GD verbunden sein.
Diagnose
• Screening-Test: Der Glukose-Toleranz-Test (GCT) kann in der 24.-28. Schwangerschaftswoche durchgeführt werden. Bei positivem Ergebnis folgt:
o Oraler Glukosetoleranztest (OGTT): Beginnt mit der Messung des Blutzuckers auf nüchternen Magen, dann nach Einnahme von 75 g Glukose nach 1 und 2 Stunden gemessen. Die Diagnose wird gestellt, wenn mindestens ein Wert die folgenden Schwellenwerte überschreitet: nüchtern ≥ 5,1 mmol/l (92 mg/dl), nach 1 Stunde ≥ 10,0 mmol/l (180 mg/dl), nach 2 Stunden ≥ 8,5 mmol/l (153 mg/dl).
Symptome
GD ist oft asymptomatisch, aber es können auftreten:
• Erhöhte Durst
• Häufiges Wasserlassen
• Müdigkeit
• Unscharfe Sicht
Therapie
• Ernährungskontrolle: Ausgewogene Ernährung mit Schwerpunkt auf Kohlenhydratkontrolle, erhöhtem Ballaststoffverzehr, regelmäßigen Mahlzeiten.
• Körperliche Aktivität: Empfohlen werden geeignete Übungen zur Aufrechterhaltung des Blutzuckerspiegels.
• Blutzuckermonitoring: Regelmäßige Überprüfung des Blutzuckers.
• Medikamentöse Therapie: Wenn Diät und Bewegung den Blutzucker nicht kontrollieren, können Insulin oder orale Antidiabetika (in einigen Ländern) erforderlich sein.
• Erziehung: Wichtig ist die Schulung im Management von Diabetes, das Erkennen von Symptomen von Hypo- und Hyperglykämie.
Auswirkungen auf Mutter und Kind
• Für die Mutter: Erhöhtes Risiko für Bluthochdruck, Präeklampsie, Kaiserschnitt, Infektionen, postpartalen Diabetes.
• Für das Kind: Makrosomie (großes Kind), Hypoglykämie nach der Geburt, erhöhtes Risiko für Übergewicht und Diabetes in der Zukunft.
Nach der Geburt
• Postpartales Screening: Frauen mit GD sollten 6-12 Wochen nach der Geburt einen Diabetes-Test machen.
• Langfristige Risiken: Erhöhtes Risiko für die Entwicklung von Typ-2-Diabetes, Notwendigkeit regelmäßiger Gesundheitsüberprüfungen.
Prophylaxe
Obwohl es nicht möglich ist, GD vollständig zu verhindern, kann das Risiko reduziert werden:
• Aufrechterhaltung eines gesunden Gewichts vor der Schwangerschaft.
• Gesundheitsbewusster Lebensstil mit regelmäßiger Bewegung und ausgewogener Ernährung.
Typ-1-Diabetes
Pathophysiologie
1. Autoimmunprozess: Typ-1-Diabetes (T1D) entsteht, wenn das Immunsystem fälschlicherweise die Betazellen der Bauchspeicheldrüse angreift und zerstört, die Insulin produzieren. Dieser Prozess kann durch folgendes ausgelöst werden:
o Genetische Faktoren: Bestimmte Gene machen Menschen anfälliger für T1D.
o Virale Infektionen: Zum Beispiel können Enteroviren als Auslöser für die Aktivierung einer Autoimmunreaktion dienen.
o Andere Umweltfaktoren: Zum Beispiel Ernährungsfaktoren in der frühen Kindheit.
2. Zerstörung der Betazellen: Infolge des Autoimmunangriffs kommt es zu einer fortschreitenden Zerstörung der Betazellen, was zu einer Reduktion oder einem vollständigen Stopp der Insulinproduktion führt.
3. Hyperglykämie: Ohne ausreichend Insulin kann Glukose nicht effizient in die Zellen transportiert werden, um als Energie genutzt zu werden, was zur Anhäufung von Glukose im Blut führt.
4. Ketoazidose: In Abwesenheit von Insulin beginnt der Körper, Fette zur Energiegewinnung zu nutzen, was zur Bildung von Ketonen führt, die sich im Blut ansammeln können und eine lebensbedrohliche diabetische Ketoazidose verursachen.
Typ-2-Diabetes
Pathophysiologie
1. Insulinresistenz: Der Hauptmechanismus der Entwicklung von Typ-2-Diabetes (T2D) besteht darin, dass die Körperzellen weniger empfindlich auf Insulin reagieren, was bedeutet, dass der Körper mehr Insulin benötigt, damit Glukose in die Zellen gelangen kann.
o Faktoren der Insulinresistenz: Fettleibigkeit, insbesondere abdominale Fettleibigkeit, Mangel an körperlicher Aktivität, eine Ernährung mit hohem Zucker- und Fettgehalt, Alter, genetische Prädisposition.
2. Reduzierte Insulinproduktion: Mit der Zeit kann die Bauchspeicheldrüse erschöpft werden, da sie mehr Insulin produzieren muss, was zu einer reduzierten Insulinproduktion führt, selbst wenn dies notwendig ist.
3. Hyperglykämie: Als Folge der Kombination aus Insulinresistenz und unzureichender Insulinproduktion steigt der Blutzuckerspiegel.
4. Betazellendysfunktion: Chronische Hyperglykämie und Insulinresistenz können zu einer weiteren Verschlechterung der Betazellenfunktion führen, was einen Teufelskreis schafft.
Gestationsdiabetes
Pathophysiologie
1. Hormonelle Veränderungen: Während der Schwangerschaft produziert die Plazenta Hormone (z.B. humanes Laktogen), die der Wirkung von Insulin entgegenwirken (Insulinresistenz), um eine ausreichende Glukoseversorgung für den Fötus zu gewährleisten.
2. Unzureichende Kompensation: Wenn die Bauchspeicheldrüse nicht genug Insulin produzieren kann, um diese Insulinresistenz zu überwinden, entwickelt sich Gestationsdiabetes.
3. Hyperglykämie: Infolgedessen steigt der Blutzuckerspiegel der Mutter, was das Wachstum und die Entwicklung des Fötus beeinflussen kann.
Allgemeine Mechanismen der Diabetesentwicklung umfassen:
• Genetische Faktoren: Beeinflussen die Anfälligkeit für Diabetes.
• Metabolischer Stress: Wie Fettleibigkeit, die die Belastung der Glukosekontrollmechanismen erhöht.
• Entzündliche Prozesse: Chronische Entzündungen können zur Insulinresistenz und Betazellendysfunktion beitragen.
• Epigenetische Veränderungen: Können die Fähigkeit des Körpers, Glukose zu managen, ohne Änderungen in der DNA modifizieren.
Risikofaktoren
Gemeinsame Risikofaktoren für Typ-1- und Typ-2-Diabetes:
• Genetische Prädisposition: Verwandte ersten Grades mit Diabetes erhöhen das Risiko.
• Ethnische Zugehörigkeit: Hohes Risiko bei Afroamerikanern, Lateinamerikanern, Ureinwohnern, Asiaten, Polynesiern.
Spezifische Risikofaktoren für Typ-1-Diabetes (T1D):
• Alter: Obwohl T1D in jedem Alter auftreten kann, wird er häufiger bei Kindern, Jugendlichen und jungen Erwachsenen diagnostiziert.
• Genetische Marker: Einige Gene (HLA-DQ und HLA-DR) sind mit einem erhöhten Risiko verbunden.
• Virale Infektionen: Einige Viren, wie Enteroviren, können ein Auslöser sein.
• Diätetische Faktoren: Frühe Einführung von Kuhmilch oder ein Mangel an Vitamin D können mit dem Risiko verbunden sein.
• Geografischer Standort: Höher in nördlichen Breiten, was möglicherweise mit weniger Sonnenlicht und Vitamin D verbunden ist.
Spezifische Risikofaktoren für Typ-2-Diabetes (T2D):
• Alter: Das Risiko steigt mit dem Alter, besonders nach 45 Jahren.
• Übergewicht: Besonders Bauchfett ist ein Schlüsselrisikofaktor.
• Körperliche Aktivität: Ein sitzender Lebensstil erhöht das Risiko.
• Geschichte von Gestationsdiabetes: Frauen mit Gestationsdiabetes haben ein erhöhtes Risiko, T2D zu entwickeln.
• Bluthochdruck: Hoher Blutdruck ist mit einem höheren Risiko verbunden.
• Dyslipidämie: Niedriger HDL-Cholesterinspiegel, hoher Triglyzeridspiegel.
• Geschichte der Geburt eines großen Kindes: Geburt eines Kindes mit einem Gewicht über 4 kg.
• Polycystisches Ovarialsyndrom (PCOS): Frauen mit PCOS haben ein höheres Risiko für T2D.
• Metabolisches Syndrom: Kombination von Übergewicht, hohem Blutdruck, hohem Blutzuckerspiegel, abnormalen Cholesterinwerten.
Risikofaktoren für Gestationsdiabetes:
• Vorheriger Gestationsdiabetes: Hohes Risiko für Wiederholung in nachfolgenden Schwangerschaften.
• Übergewicht vor der Schwangerschaft: Erhöht das Risiko erheblich.
• Alter: Frauen über 25 Jahre haben ein höheres Risiko.
• Familienanamnese von Diabetes: Besonders wenn Eltern oder Geschwister Diabetes haben.
• Mehrlingsschwangerschaft: Das Vorhandensein von Zwillingen oder mehr erhöht das Risiko.
• Geschichte der Geburt eines großen Kindes: Geburt eines Kindes mit einem Gewicht über 4 kg in einer früheren Schwangerschaft.
• Polycystisches Ovarialsyndrom: Frauen mit PCOS haben ein erhöhtes Risiko.
• Ethnische Zugehörigkeit: Dieselben Gruppen wie bei T2D haben ein erhöhtes Risiko.
Diagnose
Die Diagnose von Diabetes umfasst mehrere Schritte und Tests, die darauf abzielen, den Blutzuckerspiegel zu bestimmen, was entscheidend für die Diagnosestellung ist. Hier ist eine detaillierte Übersicht der Diagnosemethoden für die verschiedenen Diabetesarten:
Allgemeine Tests zur Diagnose von Diabetes
1. Blutzucker nüchtern (Fasting Blood Glucose, FBG):
o Der Test wird nach einem 8-stündigen Fasten (normalerweise über Nacht) durchgeführt.
o Die Diagnose Diabetes wird gestellt, wenn der Blutzuckerwert ≥ 7,0 mmol/l (126 mg/dl) in zwei getrennten Messungen erreicht wird.
2. Oraler Glukosetoleranztest (OGTT, Oral Glucose Tolerance Test):
o Nach der Messung des Blutzuckerspiegels nüchtern trinkt der Patient eine Lösung, die 75 g Glukose enthält.
o Nach 2 Stunden wird der Blutzucker wieder gemessen. Die Diagnose Diabetes wird gestellt, wenn der Wert 11,1 mmol/l (200 mg/dl) ist.
3. Glykiertes Hämoglobin (HbA1c):
o Spiegel den durchschnittlichen Blutzuckerspiegel über die letzten 2-3 Monate wider.
o Die Diagnose Diabetes wird bei HbA1c ≥ 6,5% gestellt.
o Vorteile umfassen, dass kein Fasten erforderlich ist und nur ein Arztbesuch für den Test nötig ist.
4. Zufälliger Blutzucker-Test:
o Kann in Notfällen oder bei Vorhandensein klassischer Symptome von Diabetes verwendet werden. Die Diagnose wird bei einem Wert ≥ 11,1 mmol/l (200 mg/dl) in Kombination mit Hyperglykämiesymptomen gestellt.
Spezifische Überlegungen zur Diagnose:
• Typ-1-Diabetes:
o Oft diagnostiziert bei akutem Beginn mit Symptomen von Hyperglykämie, möglicherweise mit Ketoazidose. Zusätzliche Tests auf Autoantikörper gegen Inselzellen (ICA), Insulin (IAA), Glutaminsäure-Decarboxylase (GAD65), oder IA-2 können durchgeführt werden, um den autoimmunen Prozess zu bestätigen.
• Typ-2-Diabetes:
o Wird in der Regel diagnostiziert bei fehlenden Symptomen oder leichten Symptomen, durch Screening-Programme oder während regulärer medizinischer Untersuchungen. Der Hauptfokus liegt auf FBG, OGTT oder HbA1c.
• Gestationsdiabetes:
o Normalerweise zwischen der 24. und 28. Schwangerschaftswoche diagnostiziert:
Screening-Test: Eine einstündige Test mit 50 g Glukose, wenn der Blutzuckerwert ≥ 7,8 mmol/l (140 mg/dl) erreicht, wird ein OGTT durchgeführt.
OGTT: Nach der Einnahme von 75 g Glukose wird die Diagnose gestellt, wenn mindestens ein Wert überschritten ist:
Nüchtern ≥ 5,1 mmol/l (92 mg/dl)
Nach 1 Stunde ≥ 10,0 mmol/l (180 mg/dl)
Nach 2 Stunden ≥ 8,5 mmol/l (153 mg/dl)
Weitere Aspekte der Diagnose:
• Antikörpertests: Nützlich zur Differenzierung zwischen Diabetesarten, besonders bei jungen Menschen, bei denen Typ-1-Diabetes vermutet wird.
• Differenzialdiagnose: Es ist wichtig, andere Zustände auszuschließen, die einen erhöhten Blutzuckerspiegel verursachen können, wie einige hormonelle Störungen, Medikamenteneffekte oder Stresszustände.
• Überwachung: Nach der Diagnosestellung wechseln Patienten häufig zu regelmäßiger Überwachung des Blutzuckers mit Glukometern oder Systemen zur kontinuierlichen Glukoseüberwachung (CGM), um die Erkrankung zu managen.
Wann sollte eine Diagnose durchgeführt werden:
• Bei Vorhandensein von Hyperglykämiesymptomen.
• Bei hohem Risiko basierend auf Familiengeschichte, Übergewicht, Alter oder anderen Risikofaktoren.
• Während der Schwangerschaft zur Screening auf Gestationsdiabetes.
• Im Rahmen regulärer medizinischer Untersuchungen für Personen mit Risikofaktoren.
Therapie
Medikamentöse Behandlung: Von oraler Medikation bis zur Insulintherapie, je nach Diabetes-Typ und Schweregrad.
Blutzuckermonitoring: Verwendung von Glukosemessgeräten, kontinuierlichen Glukosemesssystemen.
Lebensstil: Diät mit Kohlenhydratkontrolle, regelmäßige körperliche Aktivität, Rauchen aufgeben, Stressmanagement.
Komplikationen
Mikrovaskulär: Schäden an kleinen Gefäßen führen zu diabetischer Nephropathie, Retinopathie, Neuropathie.
Makrovaskulär: Erhöhtes Risiko für Atherosklerose, koronare Herzkrankheit, Schlaganfall.
Andere: Diabetischer Fuß, Störungen der Immunfunktion, erhöhtes Infektionsrisiko.
Prävention
Primär: Gewichtskontrolle, gesunde Ernährung, aktiver Lebensstil, besonders für Risikogruppen.
Sekundär: Früherkennung und Management von Diabetes zur Vermeidung von Komplikationen.
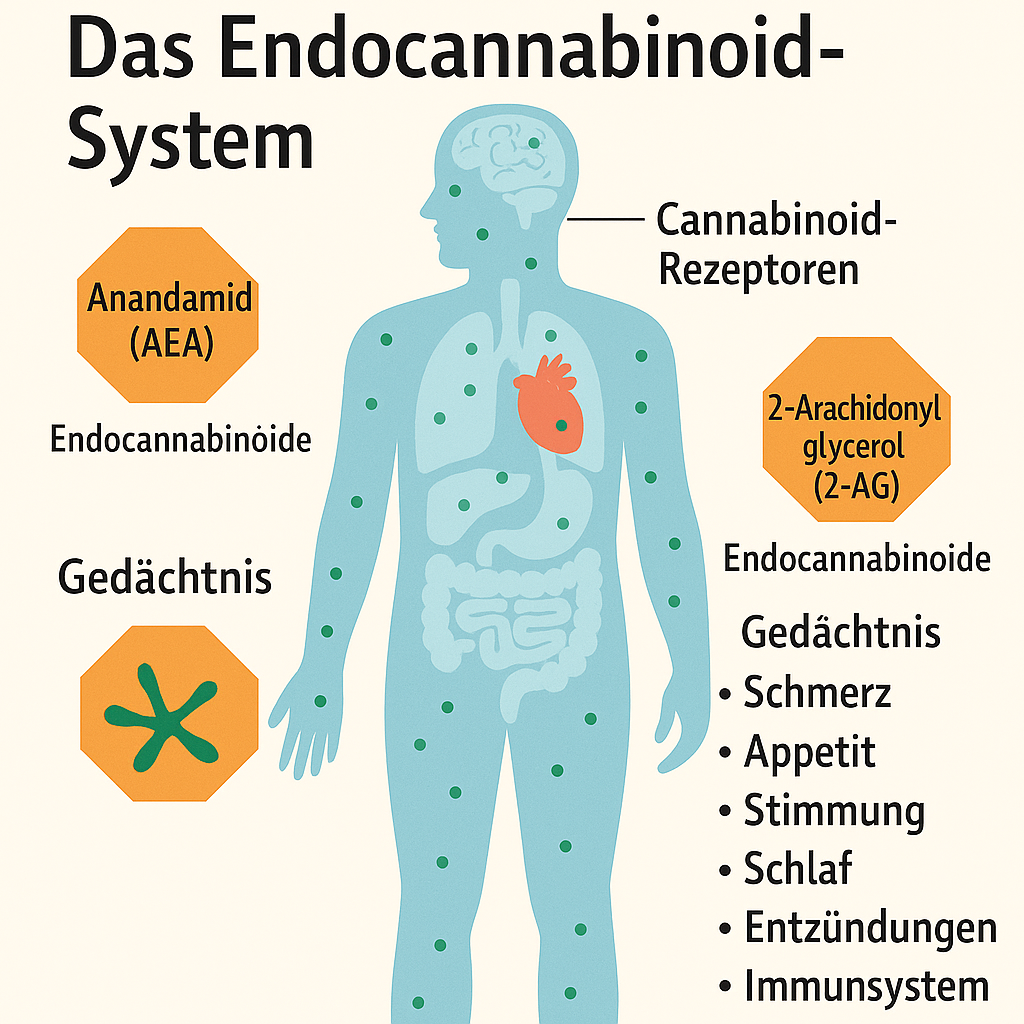
Medizinisches Cannabis
wird manchmal bei verschiedenen chronischen Erkrankungen eingesetzt, einschließlich Diabetes, obwohl es nicht unbedingt eine gängige Behandlung ist. Bei Diabetes kann Cannabis in einigen Fällen dazu beitragen, Schmerzen zu lindern, insbesondere bei neuropathischen Schmerzen, die durch Nervenschäden verursacht werden, ein häufiges Problem bei Menschen mit Diabetes.
Einige Studien deuten darauf hin, dass Cannabis helfen kann, den Blutzuckerspiegel zu stabilisieren, obwohl die Evidenz noch begrenzt ist und weiter erforscht werden muss.
Einige Studien deuten darauf hin, dass Cannabis helfen kann, den Blutzuckerspiegel zu stabilisieren, obwohl die Evidenz noch begrenzt ist und weiter erforscht werden muss.